IF=10.3|源井Luc细胞助力发现肝转移新治疗方式


IF=10.3|源井Luc细胞助力发现肝转移新治疗方式

背景
Toll样受体9(TLR9)激动剂作为免疫调节剂,能够增强检查点抑制剂(CPI)治疗肝肿瘤的活性,但是在一定程度上受到髓系抑制细胞(MDSC)独特的生物学特性以及在肿瘤特异性治疗药物递送挑战的限制。研究者表明,通过压力驱动药物递送(PEDD)系统在局部递送C型TLR9激动剂,能让药物更好地递送至肿瘤处,增强对MDSC的消耗。总体上,不管该药物递送系统有无搭配CPI,都能刺激免疫系统。
目前,CPI通常是通过静脉给药,但是该给药方式时间长、成本高,因此,研究者开始关注具有潜在优势的皮下(SQ)给药方式。
摘要
近日,Chandra C Ghosh等人在Journal for Immuno Therapy of Cancer期刊上发表了题为“Subcutaneous checkpoint inhibition is equivalent to systemic delivery when combined with nelitolimod delivered via pressure-enabled drug delivery for depletion of intrahepatic myeloid-derived suppressor cells and control of liver metastases”的研究论文。该研究使用源井生物构建的MC38 - Luc细胞来建立小鼠肝转移(LM)模型,发现皮下递送CPI与PEDD系统递送nelitolimod(一种TLR9激动剂)联合使用时,在控制肝肿瘤发展的效果与全身系统(Sys)给药途径相当,这表明皮下递送CPI与nelitolimod联合使用可能是治疗肝肿瘤的合理选择。
图文导读
研究者使用源井生物构建的MC38 - Luc细胞来建立小鼠肝转移(LM)模型。将MC38-Luc细胞通过脾脏注射到C57BL/6小鼠体内,7天后,将荧光标记的nelitolimod(10 µg/只小鼠)通过PEDD系统递送,并联合α-PD-1通过全身系统或皮下给药。通过体内成像系统监测肿瘤负荷,并在PEDD后的第3天或第10天收集组织,以富集CD45 +细胞,并通过靶向转录组学或流式细胞法分析免疫细胞群体。
为了评估CPI的药物递送方式是否会影响与nelitolimod联合使用的抗肿瘤活性,研究者在LM小鼠模型上先用PEDD递送nelitolimod,然后再通过Sys或SQ递送α-PD-1。结果显示,PEDD递送nelitolimod与皮下注射或系统性注射的α-PD-1联合使用时,都能有效地增强对肝转移肿瘤的治疗效果。
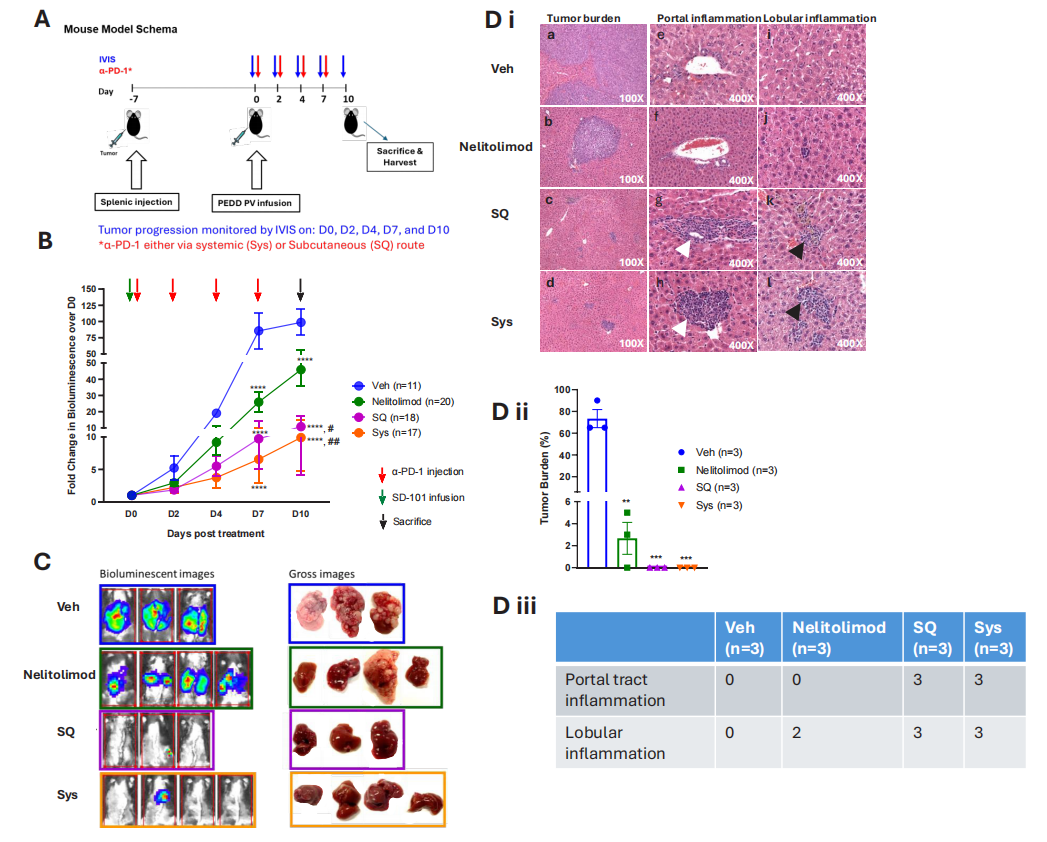
图2 无论哪种递送方式,CPI都增强了nelitolimod对肝转移的PEDD抗肿瘤活性。
研究者进一步探讨不同递送方式对肝脏TME重编程效应的差异影响,在第10天收获LM模型小鼠的肝脏,并从肝非实质细胞中分离CD45+细胞。通过量化MDSCs和免疫细胞亚群的百分比和免疫荧光分析,结果表明,PEDD的nelitolimod与SQ或Sys的α-PD-1联合使用时,都能对肝脏中的免疫细胞群体产生积极的调节作用。这包括减少具有免疫抑制作用的髓源性抑制细胞(MDSCs),特别是其中的单核细胞性髓源性抑制细胞(M-MDSC)亚群;同时增加具有抗肿瘤作用的M1样巨噬细胞、树突状细胞(CD11c+DCs)、B细胞和T细胞的数量。这种免疫细胞群体的改变有助于增强抗肿瘤免疫反应。
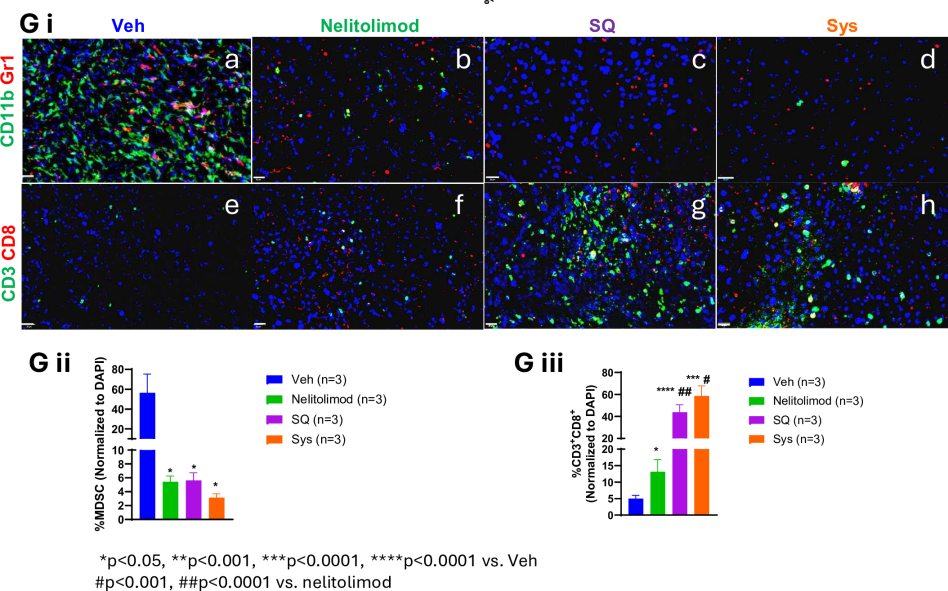
图3 通过PEDD系统递送nelitolimod对肝脏髓系和淋巴系的调节作用,在与Sys或SQ递送CPI联合使用时得到了保持
为了评估PEDD系统对nelitolimod的外周药效学效应,使用Luminex技术对第3天收集的血清进行了循环细胞因子分析。结果表明,PEDD递送nelitolimod与SQ或Sys的α-PD-1联合使用会使外周血中一些与免疫反应相关的细胞因子(如IFN-γ和CXCL10)水平升高,这表明免疫系统被激活。而且,这种治疗方式对小鼠的肝肾功能没有产生不良影响,说明其安全性较好。
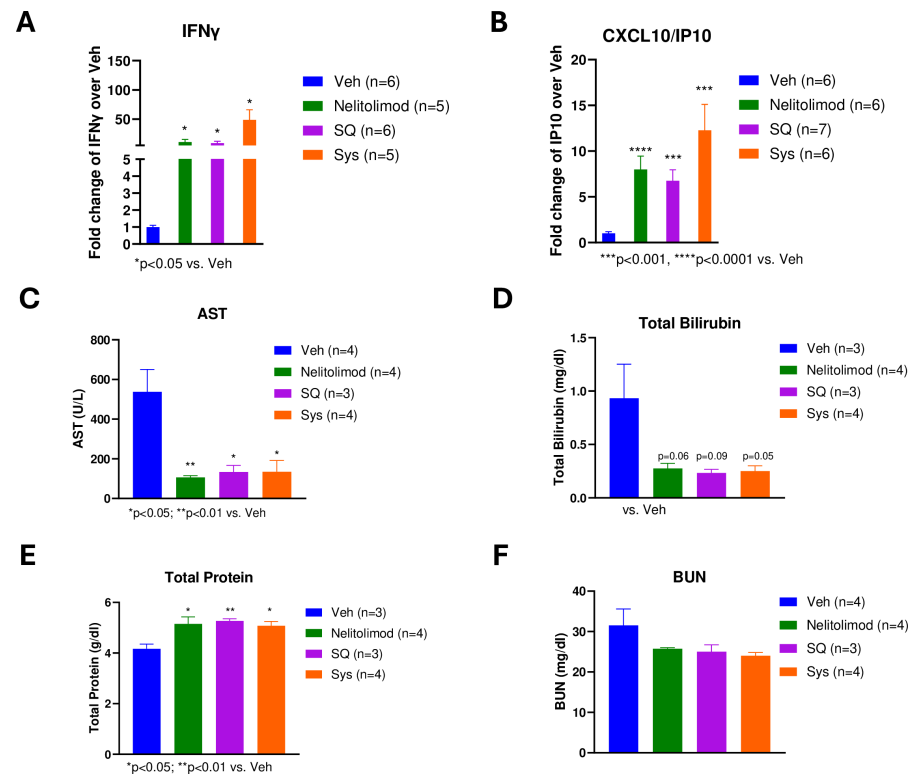
图4 PEDD递送nelitolimod与Sys或SQ α-PD-1联用的外周效应
从基因表达的角度分析,PEDD的nelitolimod与SQ或Sys的α-PD-1联合使用会导致肝脏肿瘤微环境中一系列基因表达的变化。这些变化有利于增强抗肿瘤免疫,包括上调与干扰素信号、T细胞功能和细胞免疫相关的基因表达,下调与肿瘤细胞迁移、粘附、分化以及不利于免疫反应的代谢相关基因表达。
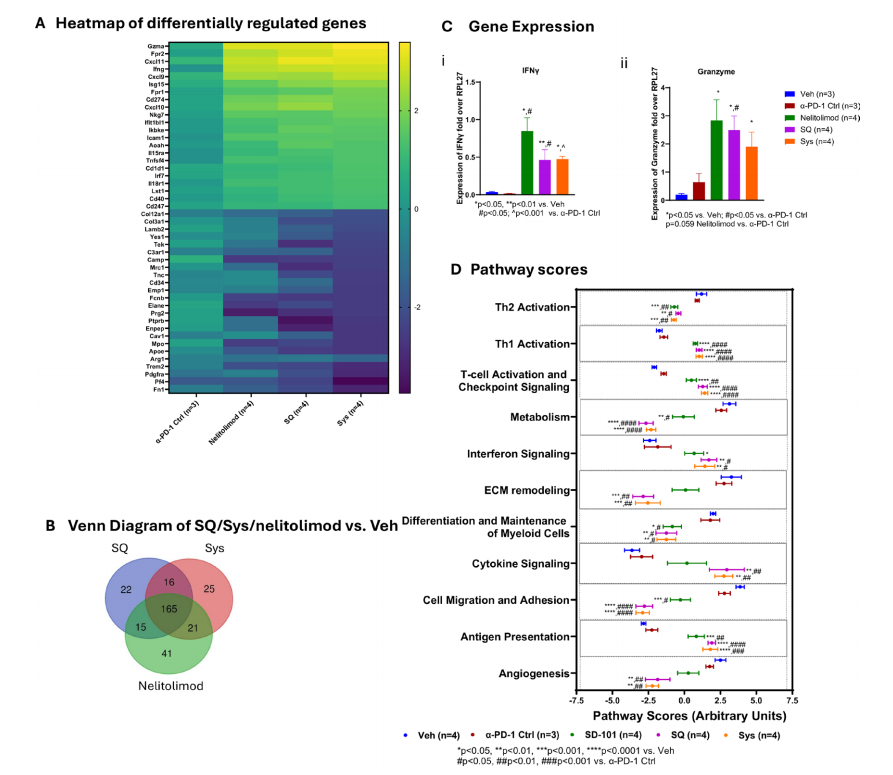
PEDD递送nelitolimod与Sys或SQ α-PD-1联用的转录组变化,与TME中增强抗肿瘤免疫一致。
结论
皮下递送CPI与PEDD递送nelitolimod联合使用时,在控制肝转移肿瘤方面的效果与全身系统递送方式相当,这表明皮下递送CPI与nelitolimod联合使用可能是治疗肝肿瘤的合理选择。
参考文献
Ghosh, Chandra C et al. “Subcutaneous checkpoint inhibition is equivalent to systemic delivery when combined with nelitolimod delivered via pressure-enabled drug delivery for depletion of intrahepatic myeloid-derived suppressor cells and control of liver metastases.” Journal for immunotherapy of cancer vol. 12,7 e008837. 22 Jul. 2024, doi:10.1136/jitc-2024-008837










