IF=26.8|源井KO细胞助力脂肪性肝病新靶点发现


IF=26.8|源井KO细胞助力脂肪性肝病新靶点发现

背景
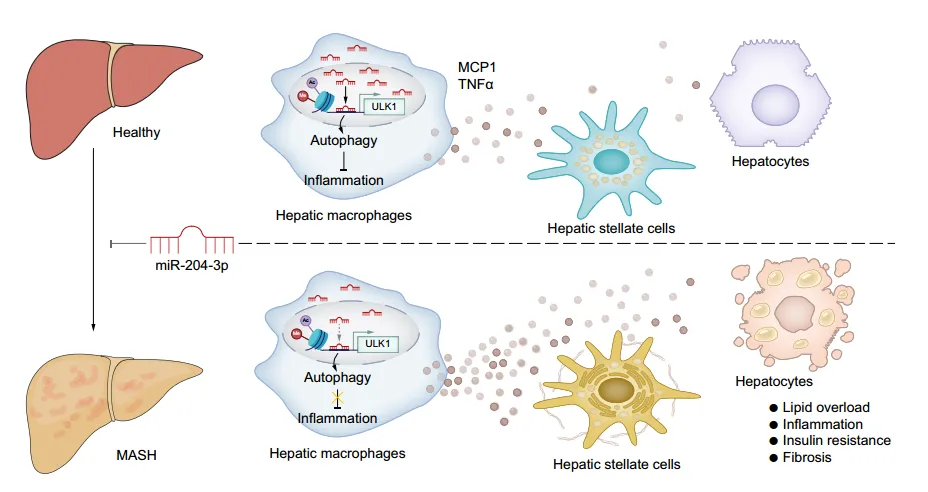
越来越多的证据表明,先天免疫特别是巨噬细胞激活,显著促进了代谢功能障碍相关脂肪性肝病(MASLD)的发展。因此,巨噬细胞参与炎症反应并与肝细胞和造血干细胞相互作用,是MASLD的潜在治疗靶点。MicroRNAs (miRNAs)是一类小的非编码RNA,可以结合和降解靶mRNA异常的miRNA的表达,调节下游基因对MASLD的发生或进展至关重要。除了靶基因的转录后调控外,已有证据表明miRNA在细胞核中存在并发挥调控作用。之前有文献报道巨噬细胞中的核miR-204-3p抑制CD36转录和巨噬细胞衍生泡沫细胞的形成,这一发现突出了miR-204-3p在调节基因转录中的核内功能,值得进一步研究。此外,miR-204-3p在几种炎症疾病相关的疾病模型中具有抗炎症作用,但其在MASLD中的意义尚不清楚。
摘要
近日,中山大学梁思佳团队在Journal of Hepatology上发表了题为“Nuclear miR-204-3p mitigates metabolic dysfunction-associated steatotic liver disease in mice”的研究论文。该研究揭示了miR-204-3p抑制巨噬细胞炎症,协调巨噬细胞对肝细胞和HSCs的作用,改善脂肪性肝病。巨噬细胞miR-204-3p可能是MASLD的治疗靶点。其中,该研究采用了源井构建的TLR4基因敲除THP-1细胞来验证miR-204-3p的抗炎作用是否依赖于TLR4/JNK信号通路的抑制。
图文导读
定量反转录PCR显示,在高脂饮食(HFD)小鼠和ob/ob小鼠的肝脏以及巨噬细胞中,miR-204-3p表达降低。从参与者获得的样本的小RNA测序分析显示,在MASLD患者的肝脏组织和外周血单个核细胞(PBMCs)中,miR-204-3p水平也下调,且PBMC中miR-204-3p水平与肝病症和损伤的严重程度呈负相关。总之,这些结果表明巨噬细胞miR-204-3p水平与肝脂肪变性、炎症、肝损伤和疾病的发生有关。
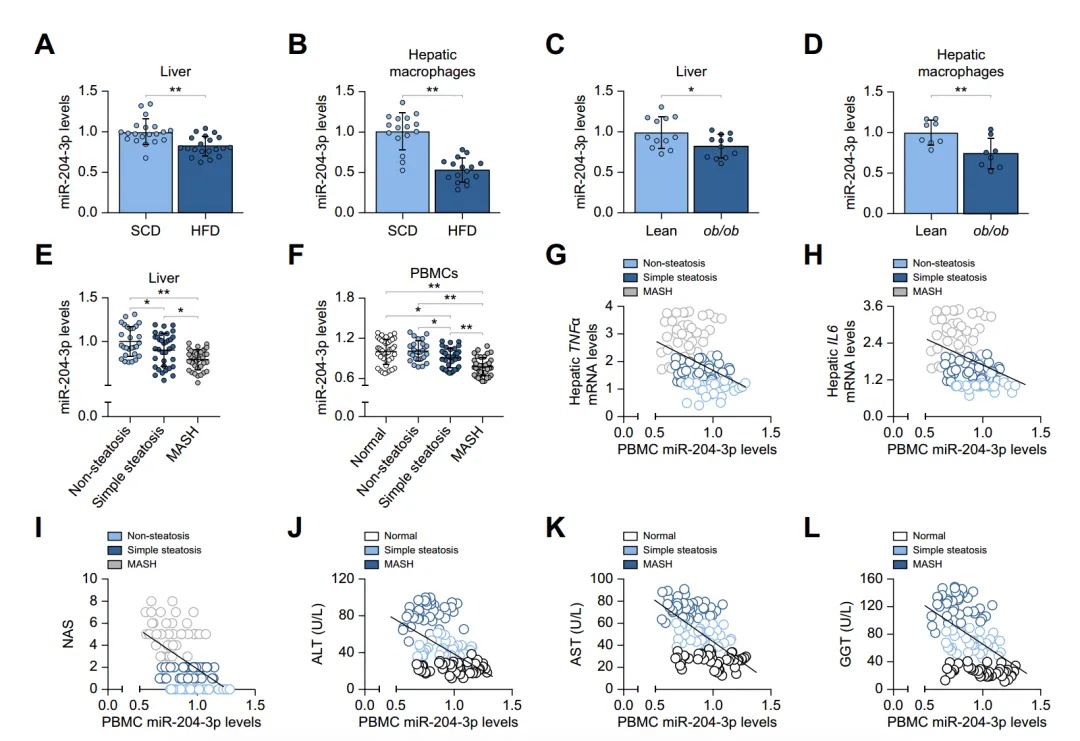
图1:MASLD样本中miR-204-3p水平降低与疾病严重程度相关
考虑到肝脂肪变性进展过程中巨噬细胞miR-204-3p水平显著降低,研究其对脂肪性肝病的潜在影响。通过向HFD小鼠注射过表达miR-204-3p的腺相关病毒(AAV-204-3p),发现巨噬细胞中miR-204-3p过表达可减轻小鼠的肝脏脂肪变性、炎症和胰岛素抵抗,改善肝脏相关指标;在甲硫氨酸和胆碱缺乏(MCD)饮食诱导的MASH小鼠模型中也得到了类似的结果;骨髓移植实验进一步证实了巨噬细胞miR - 204-3p对脂肪性肝病的负调节作用。综上说明,巨噬细胞miR-204-3p改善小鼠实验性脂肪性肝病。
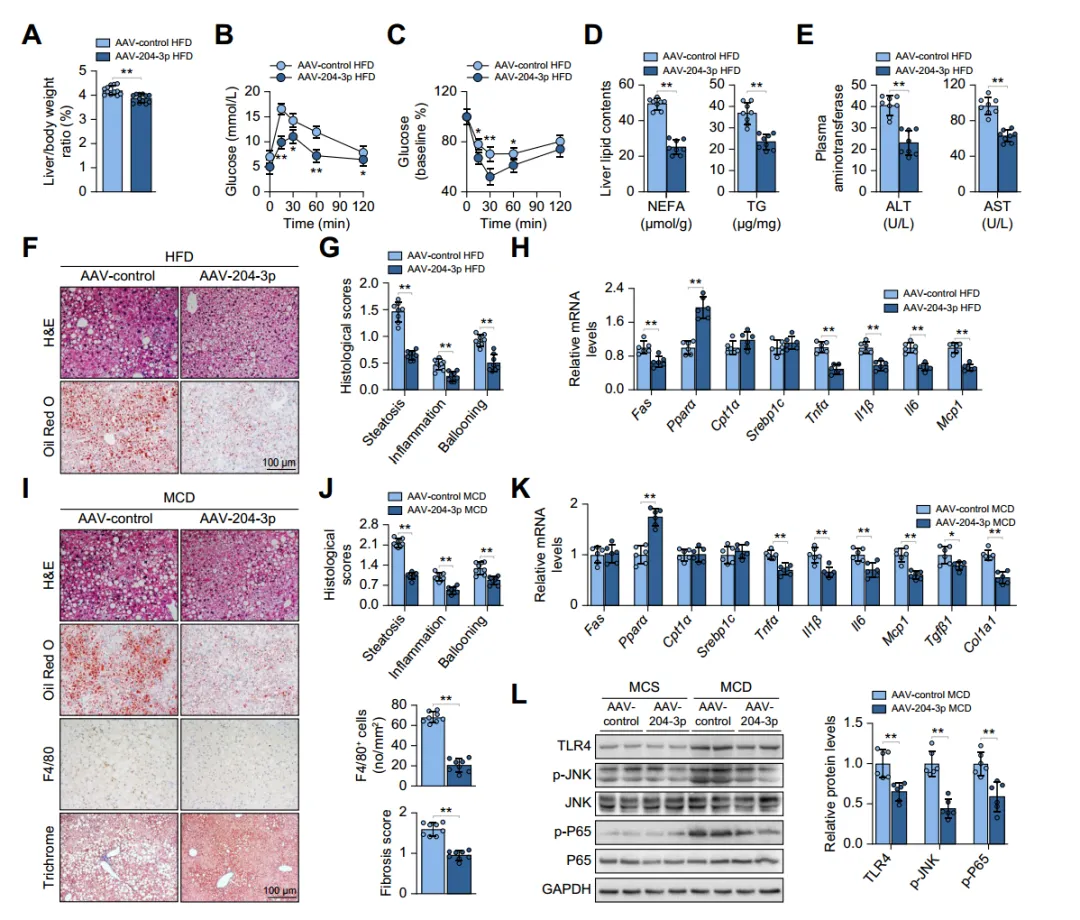
图2:巨噬细胞miR-204-3p改善小鼠实验性脂肪性肝病
作者建立了肝巨噬细胞与原代肝细胞或造血干细胞共培养体系。共培养实验表明,与HFD小鼠的巨噬细胞共培养的肝细胞脂质沉积、炎症和胰岛素抵抗增加,HSC中纤维化基因表达升高;而与过表达miR-204-3p的巨噬细胞共培养时,这些变化减弱。miR-204-3p敲低增强了巨噬细胞中JNK磷酸化以及MCP1和TNFα的分泌,但在Tlr4-/-THP-1细胞中没有这种作用,表明TLR4/JNK信号抑制是miR-204-3p发挥抗炎作用所必需的。miR-204-3p过表达的巨噬细胞中TLR4表达和JNK磷酸化降低,炎症因子分泌减少,从而抑制肝细胞脂肪变性和HSC活化。这些结果表明巨噬细胞miR-204-3p可减少促炎细胞因子的分泌,抑制肝细胞的脂肪变性变化和HSCs的纤维化活化。
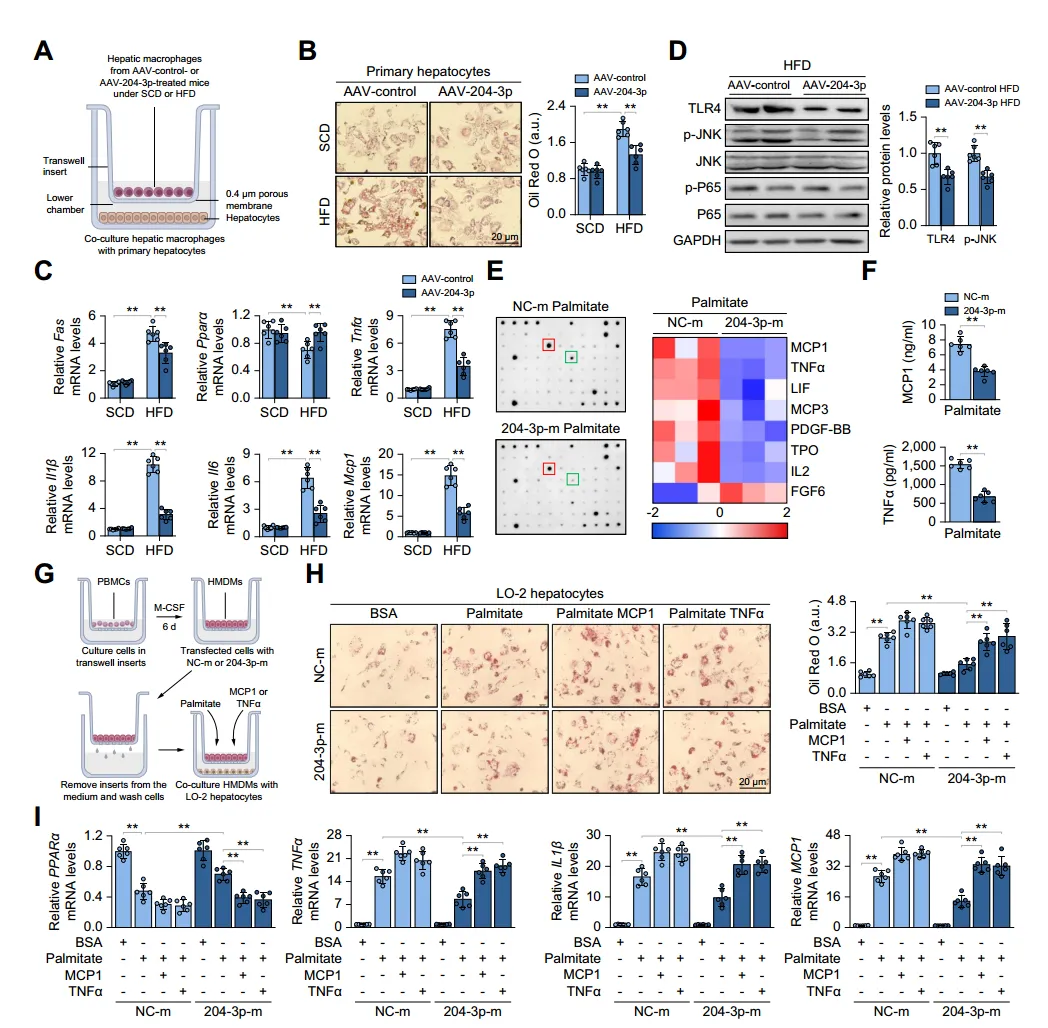
图3:巨噬细胞miR-204-3p减轻肝细胞脂质积累和炎症
为阐明miR-204-3p在巨噬细胞中抗炎作用的分子机制,作者对miR-204-3p上调后的巨噬细胞进行RNAs测序,发现表观遗传修饰相关基因本体关键词的差异表达基因富集,下调基因与MASLD相关通路高度相关;荧光原位杂交显示miR-204-3p在肝巨噬细胞中有明显核定位,在MASH和HFD喂养小鼠的肝脏中核miR-204-3p水平降低;作者确定了与代谢紊乱相关的miR-204-3p调节基因及潜在靶基因ULK1和NFXL1,实验证实miR-204-3p过表达后ULK1表达持续增加;RNA杂交预测发现miR-204-3p通过结合在ULK1转录起始位点-153bp处的保守位点上调其启动子活性和转录物水平;同时,miR-204-3p促进HMDMs中ULK1启动子上RNAPII的富集以及H3K27乙酰化和H3K4三甲基化,从而促进ULK1转录。
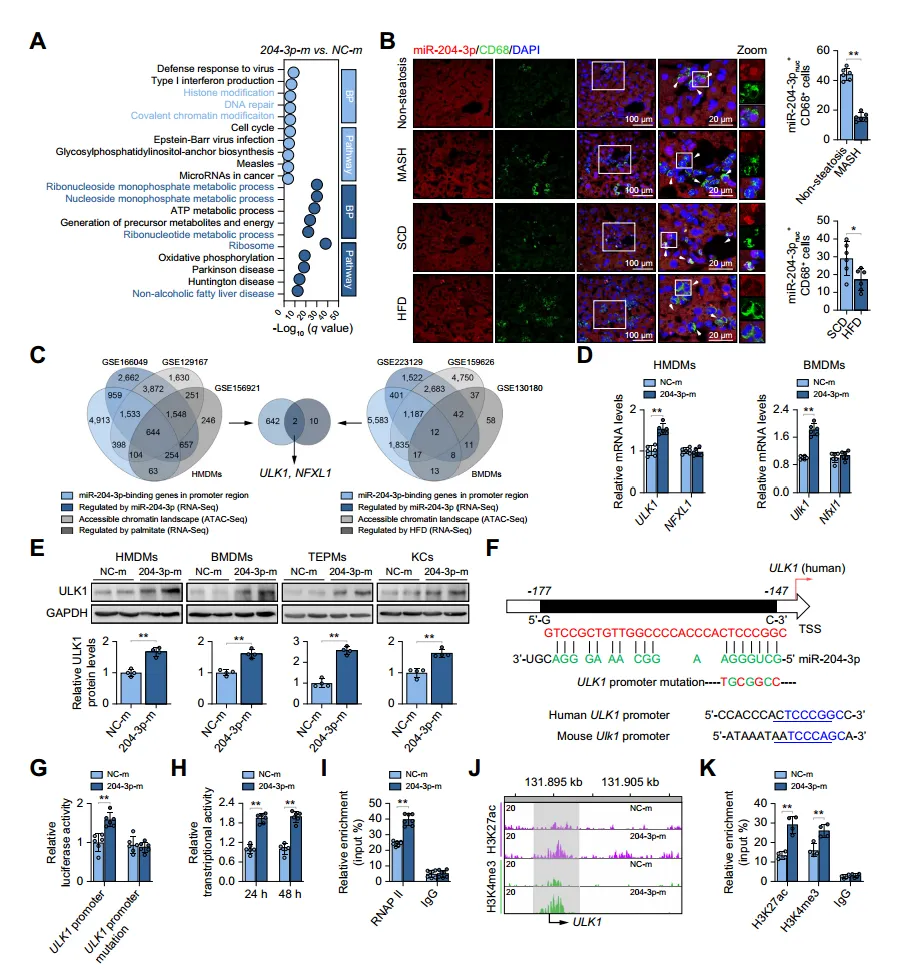
图4: miR-204-3p在细胞核中起作用,激活ULK1转录
鉴于ULK1在自噬起始中的重要性,作者研究miR-204-3p是否以自噬依赖方式限制巨噬细胞炎症,发现抑制自噬逆转了miR-204-3p对炎症反应的抑制,而诱导自噬增强了TLR4/JNK信号的失活,表明miR-204-3p与自噬相关。通过实验,作者证实miR-204-3p促进自噬体形成和与溶酶体融合,提高自噬通量,且miR-204-3p过表达上调了15个自噬相关基因的表达,其中ATG4A、AMBRA1和ULK1mRNA水平显著升高。此外,miR-204-3p通过ULK1依赖的VPS34复合物激活来调节自噬起始,ULK1抑制会消除Beclin1磷酸化和VPS34活性的升高。

图5:miR-204-3p通过恢复ULK1依赖性自噬抑制巨噬细胞炎症
为评估miR-204-3p和ULK1在肝脂肪变性中的功能关系,作者给HFD喂养的Ulk1-/-小鼠注射AAV-control或AAV-204-3p,发现Ulk1缺失会导致肝脏重量/体重比等指标增加,巨噬细胞特异性miR-204-3p上调无法逆转这种情况,且Ulk1-/-小鼠肝脏中PparamRNA水平下降,促炎因子和炎症信号分子水平升高。这些结果表明miR-204-3p对肝脏脂肪变性的保护作用主要依赖于ULK1。
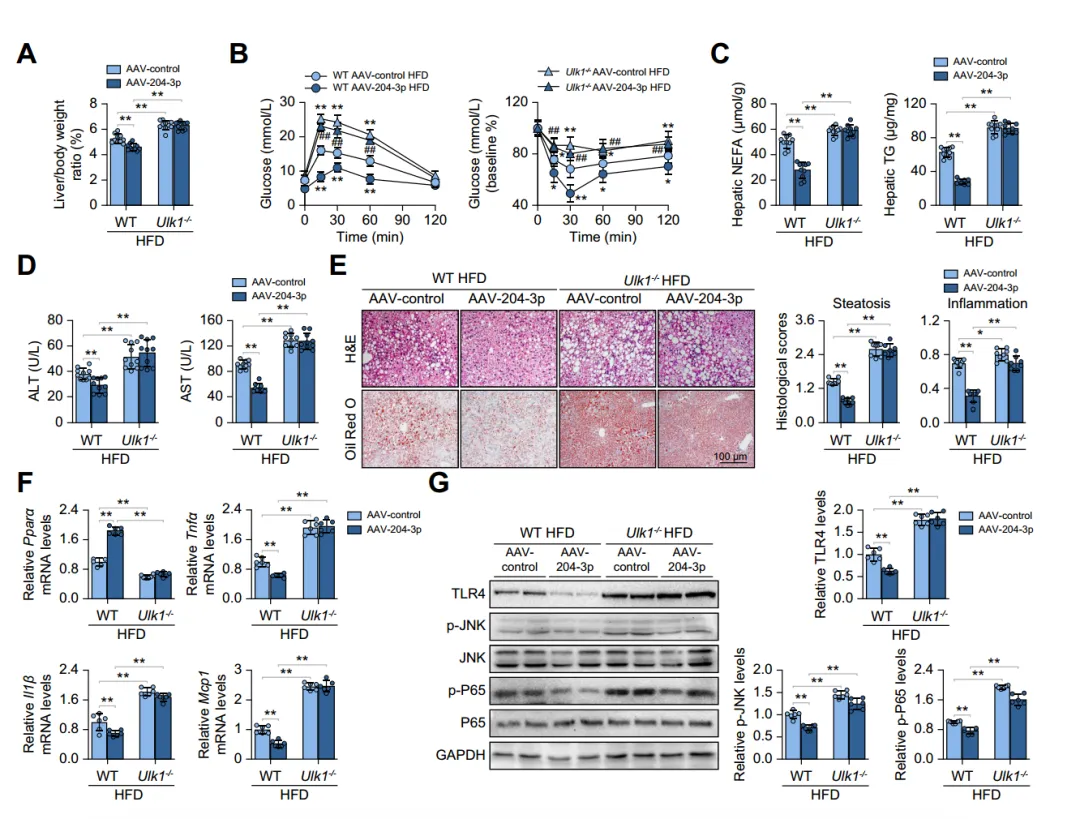
图6:Ulk1缺乏可消除miR-204-3p对MASLD的保护作用
结论
该研究证明了巨噬细胞miR-204-3p作用的新发现,它的作用依赖于ULK1表达的转录调控,它可以提高自噬通量,减少炎症反应,从而限制脂肪性肝病。因此,miR-204-3p和潜在的特异性ULK1药物激动剂可能成为代谢功能障碍相关脂肪性肝病(MASLD)的新治疗靶点。










