人卵巢颗粒细胞(KGN)的特性及应用


人卵巢颗粒细胞(KGN)的特性及应用

KGN细胞系是一种来源于人类卵巢颗粒细胞的永生化细胞系,最初由Nishi等人在1999年建立[1]。由于其能够模仿颗粒细胞的生物学特性,KGN细胞系被广泛应用于卵巢生理功能以及相关疾病的研究中。本文将介绍KGN细胞系的主要特点及其应用。
与其他卵巢肿瘤细胞系相比,它有何不同?
KGN细胞系与其他常见的卵巢肿瘤细胞系(如OVCAR-3、SKOV-3等)相比,主要在其来源、生理功能方面存在差异:
1. 细胞来源
KGN细胞系源自人卵巢颗粒细胞瘤,而颗粒细胞是卵巢中支持卵泡发育并调控激素分泌的重要细胞类型。
2. 激素反应
KGN细胞系表现出对促卵泡激素(FSH)的反应,表达功能性FSHR(促卵泡激素受体)。在刺激物 FSH 和 HMG 的作用下芳香化酶的活性增加,可分泌雌激素等激素。
3. 增殖和分化特性
KGN细胞的倍增时间较慢(46.4小时),显示出颗粒细胞瘤的典型增殖特性,并能在体外维持分化状态。
由此可见,KGN细胞系可广泛用于研究与卵泡发育、激素调控、颗粒细胞瘤及相关疾病(如多囊卵巢综合征)相关的机制,是研究生殖功能障碍及相关治疗的理想模型[2]。
KGN细胞系的应用实例
1. 卵巢功能研究
Yang等人选择KGN细胞进行自噬对激素分泌能力影响的体外验证。3-甲基腺嘌呤(3-MA)对自噬起始的抑制促进了自噬流动的顺畅,从而部分减少了KGN细胞对雌二醇和孕激素的分泌;而雷帕霉素(RAPA)阻断自噬通量进一步加剧了细胞中雌二醇和孕酮的分泌。结果表明,自噬可能影响胆固醇在卵巢中的运输,提示自噬功能障碍可能是导致激素分泌异常和滤泡闭锁的重要因素[3]。
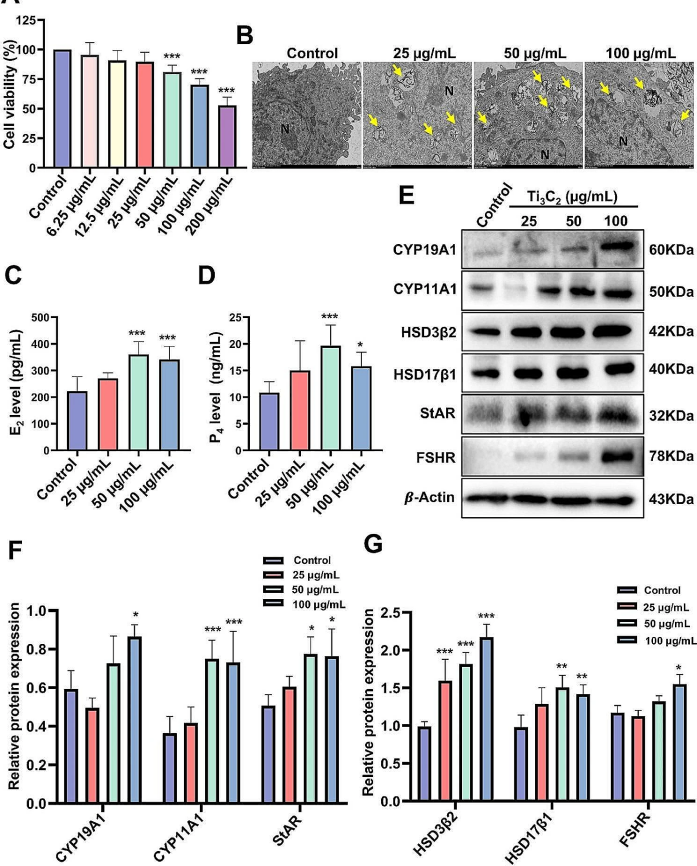
图1 Ti 的影响3C2纳米片暴露对 KGN 细胞活力和激素分泌的影响。
2. 信号通路研究
Wang等人在KGN细胞系基础上建立了FUT8-knockdown(KGN-KD)和FUT8-restored(KGN-KD-Re)细胞,通过检测核心岩藻糖基化水平、FUT8 酶活性、FUT8 mRNA 表达、细胞增殖以及 FSHR 表达和相关信号通路等指标,发现FUT8 对核心岩藻糖基化、细胞增殖以及通过FSHR调节的信号通路有重要作用[4]。
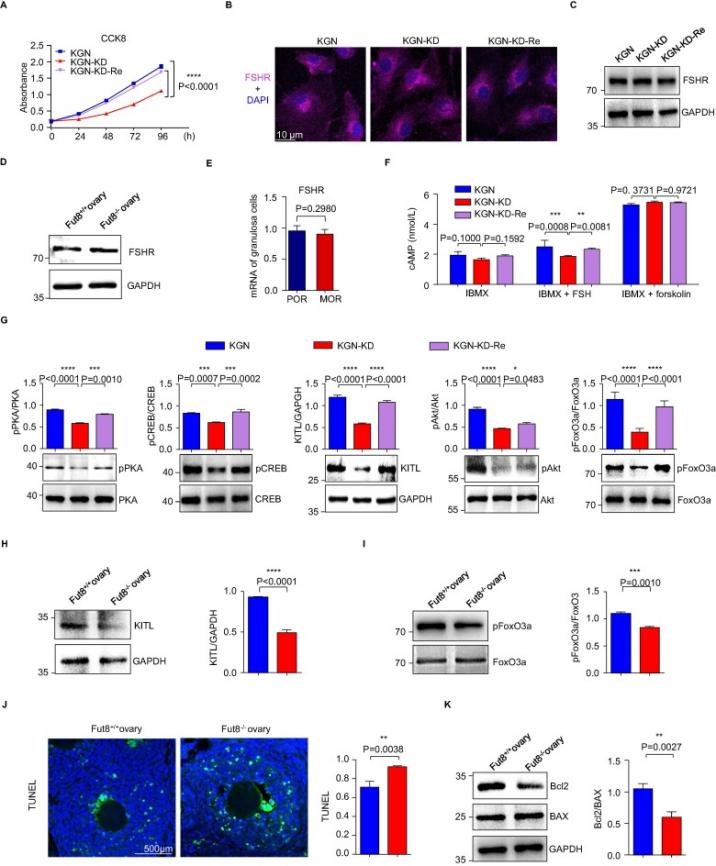
图2 FUT8 敲低减弱 FSH/FSHR 信号通路
3. 生殖疾病靶点研究
在多囊卵巢综合征(PCOS)及卵巢癌等疾病的研究中,KGN细胞为揭示疾病的分子机制提供了有力工具。Tan等人用si-NC、si-miR93-5p、oe-NC和oe-miR93-5p转染KGN细胞,用于研究GCs的功能和调控机制。研究发现miR-93-5p通过调节NF-κB信号通路促进GC细胞凋亡和铁死亡,最终确定miR-93-5p是改善PCOS患者GCs功能的新分子靶点[5]。
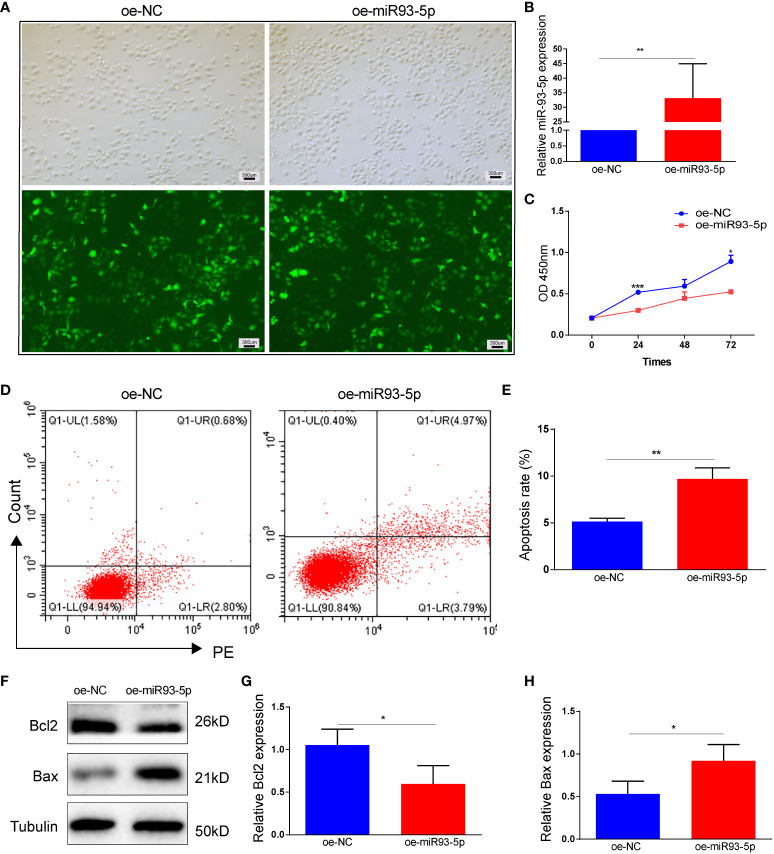
图3 过表达 miR-93-5p 对KGN细胞凋亡的影响。
4.抗肿瘤药物开发
通过KGN细胞研究药物靶点,为治疗卵巢颗粒细胞肿瘤等疾病提供新的药物策略。Bagnjuk等人评估了细胞凋亡抑制蛋白(cIAP1)在颗粒细胞瘤(GCT)中的表达,并使用KGN细胞系作为模型阐明了SMAC模拟物BV-6的影响。结果表明BV-6能够诱导KGN细胞凋亡,为治疗GCT提供了潜在的治疗方法[6]。
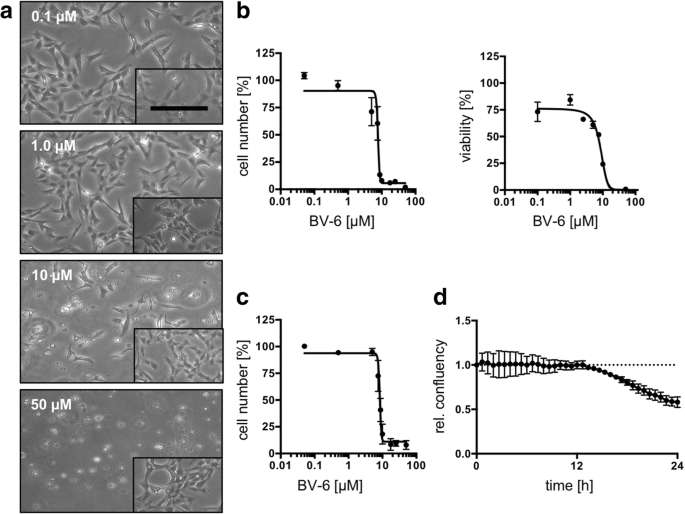
图4 BV-6治疗对KGN细胞的影响
KGN细胞系作为一种稳定的颗粒细胞模型,已经成为生殖医学研究中不可或缺的工具。它不仅在卵巢功能和激素研究中扮演重要角色,还为女性生殖系统疾病的治疗提供了研究基础。
参考文献:
1.Nishi, Y et al. “Establishment and characterization of a steroidogenic human granulosa-like tumor cell line, KGN, that expresses functional follicle-stimulating hormone receptor.” Endocrinology vol. 142,1 (2001): 437-45. doi:10.1210/endo.142.1.7862
2.Havelock, Jon C et al. “Ovarian granulosa cell lines.” Molecular and cellular endocrinology vol. 228,1-2 (2004): 67-78. doi:10.1016/j.mce.2004.04.018
3.Yang, Limei et al. “Ti3C2 nanosheet-induced autophagy derails ovarian functions.” Journal of nanobiotechnology vol. 22,1 242. 12 May. 2024, doi:10.1186/s12951-024-02495-4
4.Wang, Tiantong et al. “Core fucosylation regulates the ovarian response via FSH receptor during follicular development.” Journal of advanced research, S2090-1232(24)00038-9. 26 Jan. 2024, doi:10.1016/j.jare.2024.01.025
5.Tan, Wei et al. “MiR-93-5p promotes granulosa cell apoptosis and ferroptosis by the NF-kB signaling pathway in polycystic ovary syndrome.” Frontiers in immunology vol. 13 967151. 19 Oct. 2022, doi:10.3389/fimmu.2022.967151
6.Bagnjuk, Konstantin et al. “Inhibitor of apoptosis proteins are potential targets for treatment of granulosa cell tumors - implications from studies in KGN.” Journal of ovarian research vol. 12,1 76. 14 Aug. 2019, doi:10.1186/s13048-019-0549-6










