CRISPR/Cas9结合纳米医学治疗宫颈病变——治疗HPV感染新思路


CRISPR/Cas9结合纳米医学治疗宫颈病变——治疗HPV感染新思路
背景
宫颈癌是全世界妇科肿瘤相关死亡的主要原因,也是在妇女中第二大最常见的恶性肿瘤,而持续感染高危人乳头瘤病毒(HR-HPV)是宫颈癌发生的主要原因。由于目前HPV预防疫苗对已经患有宫颈疾病的患者无效,因此感染HPV的患者需要药物治疗来阻止宫颈疾病的进展。已有研究显示宫颈癌发生的一个可能的原因是HPV整合,诱导E7在人类基因组中保持并稳定表达。在从HPV感染到CIN到最终形成宫颈癌的漫长过程中,HPV致癌基因尤其是E7是预防和治疗的关键靶点。Poly (β-amino ester)(PBAEs)是一种广泛应用的阳离子型聚合物基因载体,具有pH敏感性、低毒性和高水溶性,在酸性给药系统中具有较高的转染效率,这使得它们与酸性阴道环境相适应,能更适用于治疗HPV感染治疗。
针对上述情况,来自武汉华中科技大学同济医学院同济医院妇产科的Jinfeng Xiong等研究人员在International Journal of Nanomedicine上发表了名为“E7-Targeted Nanotherapeutics for Key HPV Afflicted Cervical Lesions by Employing CRISPR/ Cas9 and Poly (Beta-Amino Ester)”的文章。文章中报道他们开发了由非病毒载体PBAE546和靶向HPV16 E7的CRISPR/Cas9重组质粒组成的纳米颗粒(NPs),用于治疗HPV感染和相关宫颈恶性肿瘤。

聚(β-氨基酯)546和治疗质粒构成的纳米颗粒对宫颈癌细胞生长的在体内外的抑制作用
研究人员设计了3个靶向HPV16 E7的sgRNAs(用红棉CRISPR基因编辑系统设计),并构建了CRISPR/Cas9质粒(由源井生物提供)。用NPs(PBAE546/质粒60:1)处理HPV16-阳性细胞(SiHa、CaSki和S12)和HPV16-阴性细胞(HeLa)6个小时,并在24h,48h和72h时用CCK-8法检测细胞活性。与空质粒的对照组相比,三个NPs都有效地降低了HPV16-阳性细胞活性(图1A-C),但没有观察到HPV16-阴性HeLa细胞活性的差异。为了进一步研究NPs对体内肿瘤生长的抑制作用,在裸鼠皮下接种SiHa细胞,当异种移植肿瘤增长大约35mm3时,肿瘤内注射NPs进行治疗。根据体外细胞系实验的结果,筛选出sgRNA2对细胞活性的抑制作用最好。每4天注射一次,持续20天。在SiHa皮下肿瘤小鼠中,与空质粒对照组相比,CRISPR-敲除HPV16 E7组肿瘤生长遭到显著抑制,肿瘤体积显著减小(图2),而在HeLa皮下肿瘤小鼠中,两组间无差异。
源井在这个实验中构建了靶向HPV16 E7的CRISPR质粒和对照质粒YKO-RP003-Ctrl,同时利用红棉CRISPR基因编辑系统智能设计了gRNA序列。基于数千个基因编辑成功案例与独家开发的精确算法,红棉CRISPR基因编辑系统能轻松实现基因敲除细胞方案与gRNA序列的自动化设计,点此即可免费使用>>
源井生物的gRNA载体正火热促销中,低至99元!点击查看活动详情>>
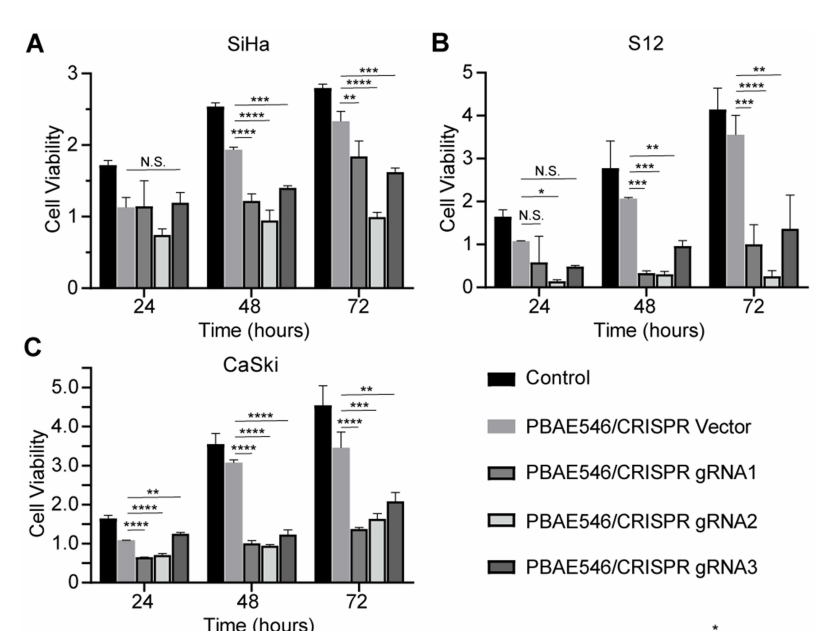
图1
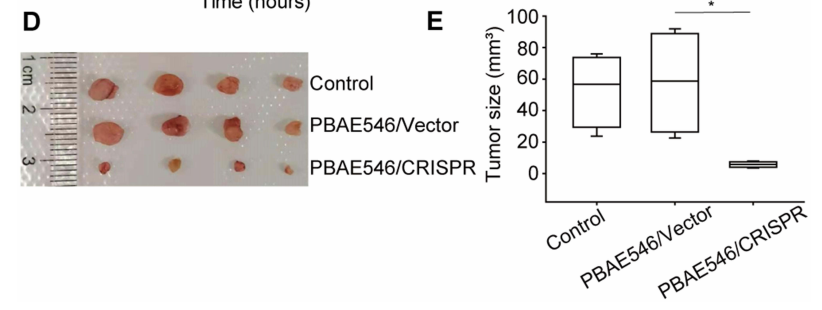
图2
敲除HPV16 E7的纳米颗粒对HPV16转基因小鼠子宫颈蛋白表达的影响
为了更接近宫颈癌初步的临床位置,并寻求非侵入性处理,研究人员使用HPV16转基因小鼠通过阴道给药进行宫颈原位治疗。持续治疗20天后,NPs组小鼠宫颈上皮的恶性表型明显逆转。上皮细胞增殖受到抑制,基底细胞排列整齐,细胞核体积减小。对照组小鼠的宫颈上皮细胞明显增生(图3A)。用免疫组化技术检测HPV16 E7及其相关蛋白的表达水平。首先,靶分子HPV16 E7和HRHPV感染替代标记物P16的表达显著降低,而与E7癌蛋白相互作用的抑癌基因RB1的表达得以恢复。第二,增殖相关蛋白Ki67和CD34、细胞周期相关蛋白CDK2、转录因子E2F1的表达明显受到抑制(图3B)。这些结果表明,靶向敲除HPV16 E7的NPs可以有效降低靶基因癌蛋白的表达,影响相关信号通路,从而逆转HPV16转基因小鼠的宫颈上皮细胞恶性表型。
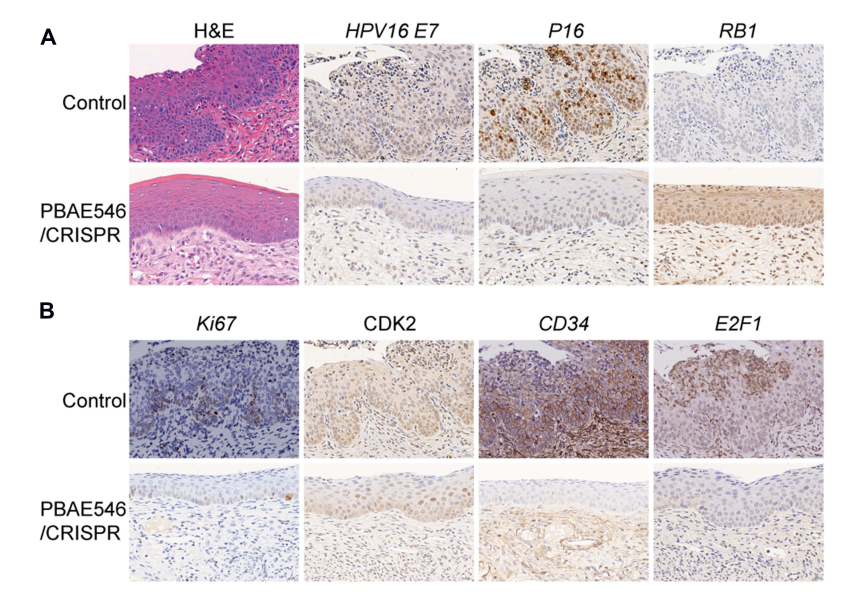
图3
总之,他们开发了由PBAE546和CRISPR/Cas9组成的NPs用于治疗HPV感染。这些NPs稳定,且在酸性的阴道中具有良好的转染效率,因此非常适合作为阴道药物。NPs通过靶向敲除E7可以有效地使HPV无效。因此,这种NPs可以在未来以阴道洗液和凝胶的形式用于治疗宫颈炎和CIN。该研究为纳米医学治疗宫颈病变的临床转化,从而预防宫颈癌提供了新的希望。
源井生物是一家专注于细胞基因编辑的企业,可在全球范围内提供优质的基因编辑细胞、稳转细胞株、病毒包装等相关服务,以及近2000种KO细胞现货库,基因敲除试剂盒等基因编辑相关产品,了解更多详情欢迎咨询我们!










