干货丨HEK293细胞培养和基因编辑Tips

技术专题

细胞培养干货
Expert Insights - Cell Culture
干货丨HEK293细胞培养和基因编辑Tips
浏览量: 98
发布日期: 2025年11月03日
干货丨HEK293细胞培养和基因编辑Tips
HEK293 细胞作为科研界的“常驻嘉宾”,无论是在高通量文库筛选、病毒包装还是蛋白表达实验等场景,都能看见它的身影。其高转染效率、稳定的表达能力以及成熟可靠的操作体系使它在各个实验平台都备受青睐。但真正要让 HEK293 在项目中稳定、高效地发挥作用,每个操作细节都至关重要。今天,小源将带你从细胞复苏、传代、冻存,到转染与单克隆铺板,全方位解析 HEK293 的实操技巧和注意事项,助你有效规避实验风险,研究推进更顺畅!
细胞信息
细胞名称:HEK293(人胚肾细胞)
细胞形态:上皮细胞样,贴壁细胞
细胞培养条件:90%DMEM+10%FBS
气相:空气,95%;二氧化碳,5%
温度:37℃
换液频次:2-3天/次
传代比例:1:3-1:6
细胞生长正常图片:细胞呈不规则多边形或梭形,边缘清晰,类似"铺路石"样排列,细胞边界清晰,单层生长不重叠

细胞生长状态差图片:细胞形态会发生改变,细胞边缘模糊,拉长、纤维化,边缘模糊、伪足增多,出现空泡或颗粒
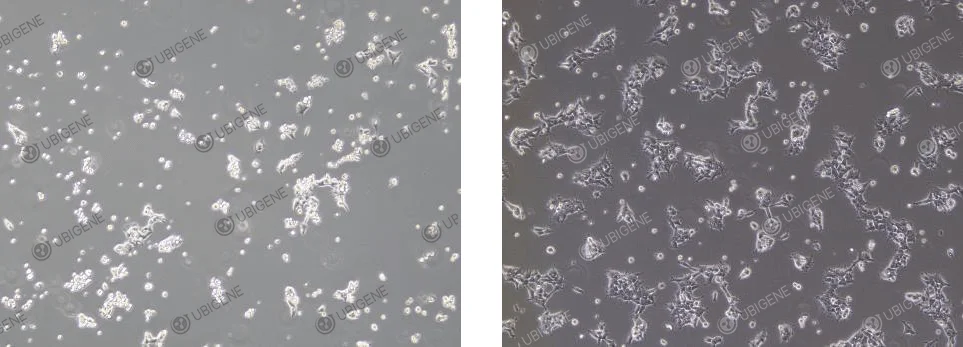
细胞复苏
- 1. 准备:取7mL完全培养基于离心管中备用
- 2. 解冻:将细胞从干冰里取出,用镊子夹住盖子放入 37℃水浴中快速晃动(注意:水不能没过盖子),使其在1分钟左右完全融化,直至冰块融化至绿豆大小,停止水浴
- 3. 离心:将解冻后的细胞悬液转移至离心管中,1100rpm条件下离心4分钟,弃去上清液
- 4. 重悬与接种:用完全培养基重悬细胞,接种于合适大小的培养皿或培养瓶中
- 5. 培养:将培养皿或培养瓶置于37℃培养箱中培养,24小时后观察细胞状态及贴壁情况
细胞传代(以T25瓶为例)
- 1. 当细胞汇合度达到80-90%时可进行传代,传代时在超净台内弃去培养瓶里的培养液,加入5mLPBS洗涤细胞1-2次
- 2. 加入1mL胰酶,轻轻晃动瓶子并使胰酶完全浸过细胞,将培养瓶放入培养箱孵育 1-2分钟,待在显微镜下观察到大部分细胞变圆变亮,轻轻晃动培养瓶两侧有大部分细胞脱落时,立即终止消化
- 3. 加入2倍胰酶体积即2mL完全培养基终止消化,然后转移至15mL离心管中
- 4. 1100 rpm 室温离心 4 分钟,离心结束,弃去上清,加入完全培养基重悬细胞
- 5. 细胞按照1:3-1:6比例传代,传代第二天观察细胞状态
细胞冻存
- 1. 收集细胞:按照细胞传代的过程收集消化好的细胞到离心管中
- 2. 离心:1100rpm条件下离心4分钟,去掉上清
- 3. 重悬与冻存:用细胞冻存液重悬细胞,按每1mL冻存液含1×10^6个细胞/mL分配到冻存管中,标注好名称、代数、日期等信息
- 4. 降温与储存:将冻存管置于程序降温盒中,-80℃冰箱中过夜后转入液氮罐内保存
细胞培养注意事项
- · 培养基和血清:确保使用正确的基础培养基和加入适量血清,配好的完全培养基需4℃保存,建议2周内使用完毕
- · 确保细胞培养环境正常
- · 操作前需预热培养基和胰酶至37℃,避免温度应激
- · 传代时机: 汇合度 80-90% 时传代,通常每2-3天传代一次
- · 细胞传代操作:注意消化时间和胰酶浓度,避免因消化时间过长或过短导致的细胞损伤;避免过度吹打而造成细胞膜的损伤;贴壁不均匀时可轻摇培养瓶使细胞分布均匀
- · 细胞不贴壁:检查血清质量;使用包被过的培养器皿;改用含EDTA的0.05%胰酶(如TrypLE™),消化时间缩短至30-60秒
细胞转染时注意事项
- 1. 确保细胞状态良好,使用处对数生长期即汇合度在70-80%的细胞,且细胞活率>95%时可通过台盼蓝进行检测。
- 2. 注意细胞消化时间,避免过度消化,对细胞造成伤害
- 3. 实验过程中细胞要吹打成单细胞,避免细胞聚团
- 4. 转染试剂使用前需要充分混匀保证其均匀性
- 5. 建议进行药筛预实验找到最佳药筛浓度,以便于转染后进行药筛
- 6. 电转法:
- 1) 电转时需控制好细胞量,电转后根据细胞量接种到合适的培养板里
- 2) 用PBS洗涤细胞1-2次,彻底去除残留血清,避免离子干扰电穿孔
- 3) 可进行预实验对电转参数进行优化
- 4) 需保证电转后细胞贴壁率≥70%
- 5) 需控制好实验时间,电转全程不宜过长
- 7. 慢病毒法:
- 1) 进行正式实验前可进行预实验找到最合适的MOI
- 2) 感染病毒前细胞汇合度控制在30-40%之间,不可过高
- 3) 感染前添加助染剂Polybrene
- 4) 感染后24h进行换液
- 5) 感染使用的病毒液避免反复冻融
- 8. 脂质体法:
- 1) 选择适合HEK293细胞的脂质体转染试剂,通过预实验确定最佳转染条件
- 2) 转染前24h进行细胞铺板,转染前细胞汇合度控制在60-70%
- 3) 先稀释DNA于Opti-MEM,再加脂质体(反向混合会失效)
- 4) 室温静置15-20分钟(<10分钟复合不充分,>30分钟毒性增加)
- 5) 复合物添加时沿培养器皿边缘逐滴加入,并轻摇混匀,避免直接冲击细胞
铺单克隆实验注意事项
- · 使用对数生长期的细胞进行铺克隆,铺克隆前细胞汇合度建议控制在70%左右
- · 铺克隆时细胞活率≥90%
- · 提前预温所有试剂(包括培养基、胰酶、PBS)
- · 建议使用温和消化试剂(如TrypLE Express)
- · 可先进行预实验找到合适的铺克隆梯度,避免单克隆占比太低
- · 细胞接种96孔板时需确保细胞分布均匀;外围96孔加入PBS防止蒸发
- · 使用“梯度稀释法”进行铺克隆,稀释细胞计数后结果最好落在1*10^6-2*10^6之间
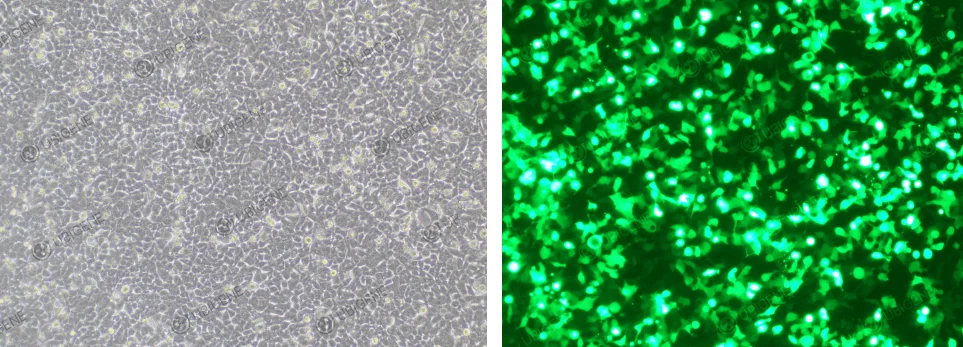
电转法感染图
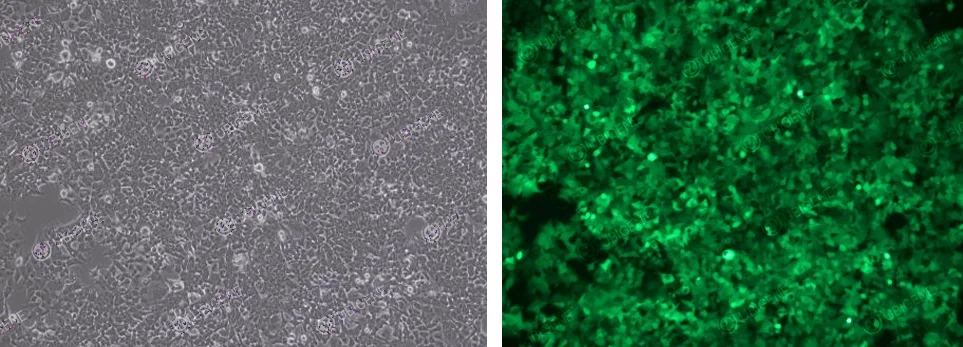
慢病毒感染图
相关服务推荐
基因敲除细胞系
基于CRISPR-U™专利技术,源井生物根据不同细胞特点选择适宜的转染方法(电转法或病毒法),将gRNA和Cas9转入细胞中,然后进行单克隆筛选,通过靶位点扩增及测序验证筛选出成功敲除的阳性克隆,最终交付纯合子细胞株与相关数据报告。











