一文解锁如何快速构建稳定的基因敲除细胞系?

稳定基因敲除细胞系 是基础科研、药物靶点验证及细胞治疗研究的核心工具,其构建效率直接决定项目推进速度与实验可靠性。CRISPR/Cas9等基因编辑技术的普及,虽大幅降低了敲除门槛,但从靶点设计到稳定株验证的全流程仍存在诸多关键节点,任一环节疏漏都可能导致实验延期甚至失败。在本篇文章中,小源将结合实操经验与技术要点,系统拆解快速构建稳定基因敲除细胞系的核心因素,助力科研人员少走弯路。
一、靶点与基因特性的前期评估
前期评估是稳定基因敲除细胞系构建的“前置风控”,决定着项目是否“值得做”,直接规避因基因特性导致的无效投入,核心围绕“目标基因必要性”与“可编辑性”展开。
首先需明确目标基因是否为必需基因
研究表明,人类基因组中约10%的基因为细胞存活必需基因,这类基因彻底敲除后会导致细胞死亡或增殖停滞,即便sgRNA切割效率优异,也无法获得纯合敲除克隆。可通过DepMap、DEG等公共数据库,或源井生物 EZ-editor™基因编辑工具, 一键评估基因致死风险,同时查询同源细胞系的敲除成功案例,降低实验不确定性。
源井生物EZ-editor™基因编辑工具
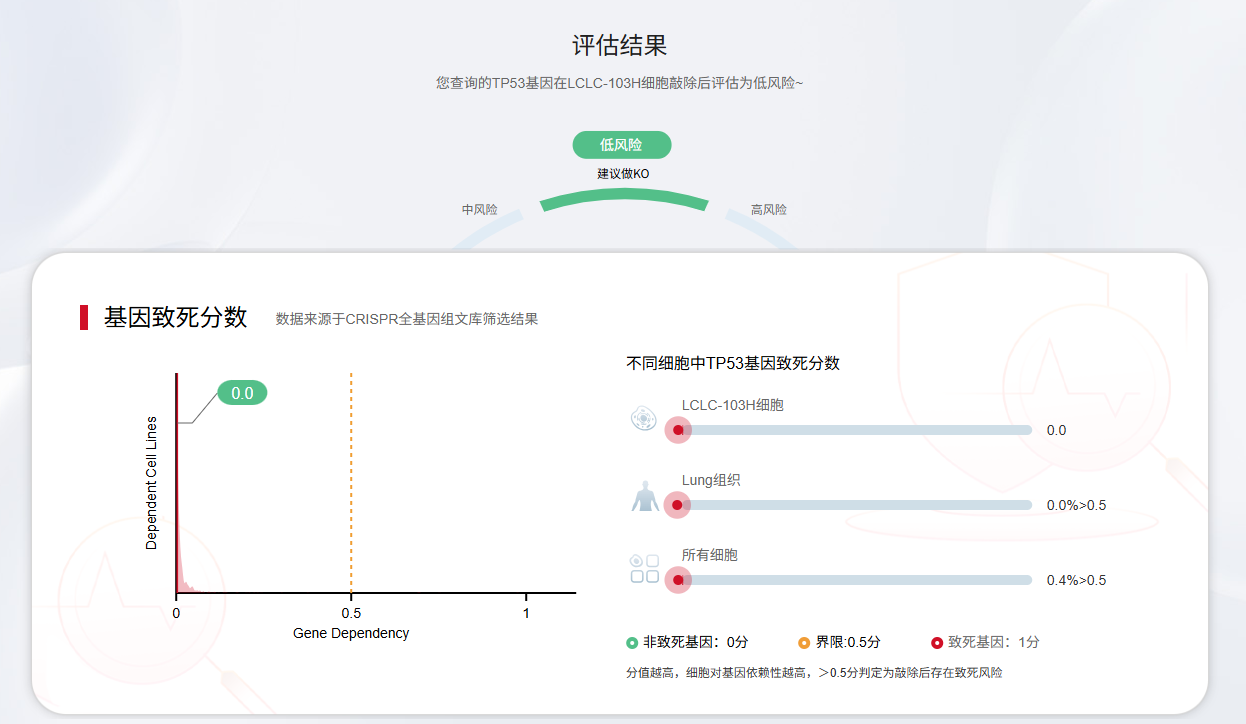
评估结果展示
其次需梳理基因基础信息
借助NCBI、Ensembl数据库确认靶基因的转录本差异、可变剪接位点及功能结构域,避免因靶点设计在非公共外显子区域,导致部分转录本无法被编辑;同时评估基因拷贝数,多拷贝基因需确保每个等位基因均被破坏,否则易出现蛋白残留表达。此外,结合细胞特性预判实验难度,如原代细胞、干细胞等难转染细胞系,需提前规划递送策略。
二、sgRNA设计与编辑策略
sgRNA的设计质量是决定基因编辑效率的关键,直接影响靶点切割精度与脱靶风险,合理的编辑策略能进一步提升命中率。
sgRNA设计需遵循三大核心原则:
-
靶向关键功能域
优先选择基因编码区(CDS)的前1/3区域,尤其是第一、二外显子,确保编辑后引发移码突变,彻底破坏蛋白功能; -
控制序列特性
GC含量维持在30%-70%,避免4个以上连续T碱基结尾,5'端优先为G或GG以提升转录效率,同时严格匹配PAM序列(SpCas9常用NGG); -
低脱靶风险
通过CRISPOR、Benchling等工具预测潜在脱靶位点,优先选择特异性评分高的sgRNA。
多sgRNA并行设计是提升命中率的关键策略。 单一sgRNA可能因序列可及性不足导致切割效率低下,同时设计2-3条靶向同一基因不同外显子的sgRNA,通过细胞池筛选(Cell Pool)验证编辑效率, 保留活性最高的靶点 推进后续实验。此外,双sgRNA协同切割策略能实现片段基因删除,进一步提升敲除彻底性。
源井生物依托CRISPR-U™基因编辑平台,搭建了sgRNA设计平台 —— 红棉·CRISPR基因编辑系统 ,结合1400+细胞系的海量敲除数据,优化靶点选择算法,同时采用双sgRNA协同切割与高通量编辑评估体系,使敲除效率较传统方案提升 10-20倍。
红棉·CRISPR基因编辑系统
三、基因编辑方式的选择
基因编辑方式与细胞系的匹配度,直接影响转染效率、细胞活性及实验周期,需结合细胞特性与项目需求精准选择。
细胞系选择是基础
根据实验需要选择合适的细胞系,如果没有指定的细胞系,可以考虑一些常用细胞系如HEK293T、HCT116,这类细胞系转染效率较高、生长速率稳定适配化学转染、电穿孔等多种递送方式;如果是原代细胞、免疫细胞、干细胞等难转染细胞系,需考虑采用病毒介导递送(慢病毒、腺病毒)或RNP递送体系,有助于提升转染效率,但其中一些环节(如载体构建、病毒包装)会使周期延长。此外,需提前验证细胞的药物敏感性,确保筛选标记(嘌呤霉素、潮霉素)的有效浓度,避免浓度过高导致细胞大量死亡。
递送与编辑体系选择需兼顾效率与安全性
建议先通过预实验确定最适合的转染方式,不同转染方式有不同的特点。化学转染适合易转染细胞,操作简便、成本低,周期短;电穿孔递送效率高,适配多数细胞系,但需优化电压、脉冲时间等参数,减少细胞毒性;慢病毒递送可实现稳定整合,适合长期培养,但存在随机整合风险。
源井生物针对不同细胞系特性优化递送方案,灵活采用质粒法、RNP法、病毒法,结合现货载体资源,大幅缩短载体构建与递送周期。
四、单克隆筛选与扩增
多数科研人员面临的核心困境可能是:转染与切割效率达标,但始终无法获得纯合敲除单克隆 ——本质是卡在单克隆筛选环节。 细胞池(Cell Pool)中往往混合纯合敲除、杂合突变及未编辑细胞,若不进行单克隆分离,残留细胞会掩盖敲除表型,导致实验结果波动。
高效筛选需遵循标准化流程
第一步是细胞池富集,转染48-72小时后,通过抗性筛选或荧光报告筛选,淘汰未编辑细胞,提升编辑细胞比例;
第二步是单细胞分离,常用有限稀释法与流式细胞分选(FACS)。
克隆培养与初筛需严控细节
单细胞培养2-3周后,对可见克隆进行编号与低代次传代,避免细胞漂移;提取基因组DNA后,通过PCR扩增+Sanger测序,快速鉴定突变类型,筛选纯合敲除候选克隆。
源井生物通过标准化单克隆筛选流程,结合基因型分析系统一键解析测序结果,大幅缩短初筛周期,同时并行培养多个候选克隆,降低后续验证失败风险。
五、稳定性验证
稳定基因敲除细胞系需满足“多代传代后敲除效果不变”,需从DNA、RNA、蛋白三个层面开展立体验证,避免假阳性结果。
DNA水平验证
通过PCR扩增靶区域并测序,确认纯合敲除基因型稳定,无回复突变;对于多拷贝基因,需确保所有等位基因均发生有效突变。
RNA水平验证
采用RT-qPCR检测靶基因mRNA表达,若出现显著下调且无异常剪接产物,说明突变转录本被无义介导的mRNA降解(NMD)系统清除;若存在异常条带,需通过序列比对确认是否为外显子跳跃产物。
蛋白水平验证
通过Western Blot检测目的蛋白表达,预期野生型条带完全消失,无截短或融合蛋白残留;必要时结合免疫荧光、质谱分析进一步确认。但是蛋白水平验证结果受诸多因素干扰,需要谨慎看待。
此外,需进行长期稳定性验证
将细胞传代后,重复上述验证流程,同时进行STR鉴定与支原体检测,确保细胞身份一致、无污染,最终建立低代次冻存细胞库,为后续实验提供稳定材料。
六、风险控制
基因敲除实验中存在多种潜在风险,尤其是难敲基因、致死基因的处理,合理的风险控制策略能显著提升整体效率。
针对必需基因或高致死风险基因,小源建议可以考虑以下替代策略:
- 额外加添加剂
- 考虑杂合子是否符合实验要求
- 改用RNAi介导的基因敲低
- tet on/tet off 诱导敲除
其他风险应对:
脱靶效应可通过设计特异性sgRNA、设置阴性对照(空载体转染)及全基因组测序验证规避;为防止细胞污染,需在实验全程严格无菌操作,定期检测支原体;敲除不彻底可通过优化sgRNA靶点、采用双sgRNA策略或更换编辑方式解决。
源井生物拥有 8000+KO细胞产品,实现“即买即用”快速交付,同时提供快至4周极速定制服务,结合全流程质控体系,为高风险项目提供专业解决方案。
结语
稳定基因敲除细胞系的快速构建,本质是对从靶点评估、设计编辑再到筛选验证以及风险控制这一全流程的精准把控。从前期规避致死基因风险,到sgRNA设计与编辑方式的优化,再到单克隆筛选与多维度验证的标准化操作,每个环节都需兼顾科学性与实操性。借助源井生物CRISPR-U™平台的技术优势、现货资源与标准化流程,可大幅缩短构建周期、提升成功率,为您科研项目的高效推进提供核心支撑。
联系我们了解更多>>>









