CRISPR文库高阶应用解析:从顶刊看靶点筛选策略的科学设计


CRISPR文库高阶应用解析:从顶刊看靶点筛选策略的科学设计

靶点发现一直是基础与转化医学研究中的核心环节。一个关键靶点的识别,往往意味着研究方向的重大突破,也可能是通往高影响力论文的起点。近年来,CRISPR文库筛选作为一种系统性、高通量的功能基因筛选技术,已成为科研人员寻找新靶点、探索疾病机制、开发新药靶标的重要利器。
本文将结合Nature杂志近期一项肺癌转移研究,系统拆解这项CRISPR文库实验的设计思路与技术路径,深入解析如何将文库筛选与疾病模型深度融合,筛出真正具有生物学意义的靶点,助力高分文章产出。

Nature杂志近期一项肺癌转移研究
背景聚焦:肿瘤免疫逃逸与转移早期靶点挖掘
原位肿瘤在转移过程中,大部分肿瘤细胞会被宿主免疫系统清除,唯有少部分播散性肿瘤细胞(Disseminated Tumor Cells, DTCs)能够逃逸识别,进入远端器官并进入休眠状态。这些休眠细胞通过下调MHC-I及NK细胞识别配体等机制,避免了T细胞与NK细胞的攻击。
一段潜伏后,这些DTCs可能重新进入增殖状态,进入所谓的“转移早期阶段”(incipient metastasis),并最终发展为可检测的转移灶(macrometastasis)。本研究聚焦于识别限制DTC再激活的免疫因子,为理解肿瘤早期转移免疫调控机制提供了重要线索。
![图1. 基于hPSCs的疾病建模与药效评价应用[1]](/uploads/allimg/250620/36-250620151Z2223.webp)
图1 肿瘤细胞转移逃逸模型[1,2]
实验设计与CRISPR文库筛选流程解析
第一步: 定制化 sgRNA 文库设计:小而精的策略
亮点策略: 靶向性强的小型定制文库,精准聚焦免疫通路
- · 文库目标: 探究免疫系统限制转移初期DTCs再激活的关键因子。
- · 设计思路: 围绕免疫识别相关通路选取候选基因,文库覆盖220个目标基因。
-
· 三类主要靶点来源:
- 1. MHC-I/NK配体相关基因(直接影响T细胞/NK识别)
- 2. 干扰素α/γ及补体系统基因(基于单细胞转录组+GSEA分析获得)
- 3.STING、RNA识别、LPS相关信号通路基因(干扰素信号上游)。
每基因设计5条sgRNA,构建为多个亚文库(每库约20个基因),保障代表性与技术可控性。
第二步:文库转导与细胞准备:高代表性建库策略
· 细胞系: 人肺腺癌细胞系 H2087-LCC 与 KPad1
· 转导方式: 慢病毒感染,MOI = 0.3,覆盖度 >1000x
· 筛选方式: >嘌呤霉素(2.5 μg/mL)筛选4天,获得稳定表达文库的细胞库
第三步:体内筛选设计:免疫模型联合流式分选
亮点策略: 体内模型模拟免疫逃逸过程 + 荧光分选靶细胞
- · 小鼠模型: 免疫缺陷小鼠(允许肿瘤细胞迅速扩增)
- · 注射方式: 心脏/尾静脉注射,建立多器官转移模型
-
· 分组设计:
- 1. 对照组: 转移初期休眠状态DTCs
- 2. 实验组: 已激活扩增形成微转移灶的细胞
- · 分选方式: 活体成像追踪 + 荧光标记肿瘤细胞流式分选
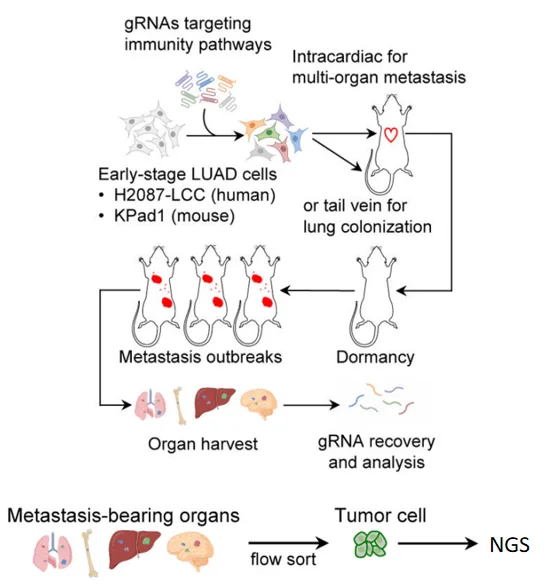
图2 CRISPR文库筛选流程图[1]
第四步:NGS测序与生信分析:双模型交叉验证靶点
· 分析逻辑: 实验组与对照组之间sgRNA富集度差异
· 关键结果: MHC-I及NK配体相关sgRNA在实验组中显著富集
· 双细胞模型验证: H2087-LCC 与 KPad1中均识别出STING信号通路为共同靶点
· 分析工具: MAGeCK / edgeR / GSEA等主流方法进行差异sgRNA筛选与通路富集分析
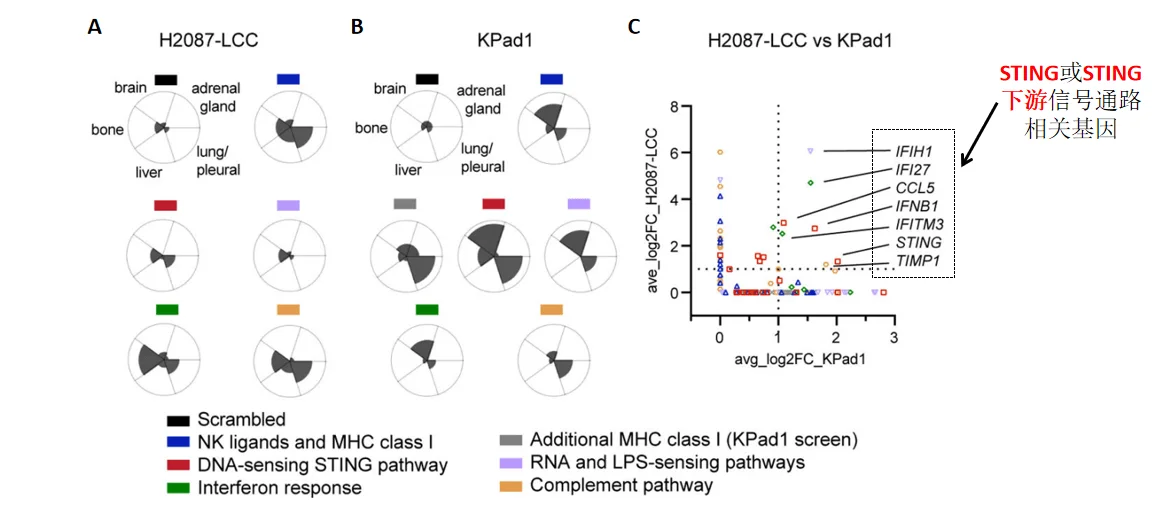
图3 生信分析筛选靶点[1]
A. H2087-LCC细胞注射组,不同组织中sgRNA富集程度;B. Kpad1细胞注射组,不同组织中sgRNA富集程度;C. 上述两组细胞的sgRNA富集分析。
第五步:靶点验证:从表达水平到功能实验证实关键基因作用
· STING表达检测: 免疫荧光证实其在转移早期阶段上调
· 功能实验:
- 1. STING敲除 → 转移灶加速扩增
- 2. STING过表达 → 抑制早期肿瘤细胞的增殖再激活
该实验从文库构建到体内功能验证实现了“闭环筛选”,完整阐明了STING通路在抑制DTC再激活中的核心作用。
![STING靶点验证[1]](/uploads/allimg/250620/36-2506201521294N.webp)
图四 STING靶点验证[1]
A&B. 两种细胞中STING信号强度对比。相较于休眠期细胞(Ki67low),转移初期细胞(Ki67high)的STING信号显著增加;C. 敲除KPad1细胞中Sting基因后,肿瘤细胞增殖显著增加;D. Tet-On系统过表达Sting基因后,肿瘤细胞增殖被显著抑制;E. 敲除Sting基因后,各器官中的肿瘤细胞均明显增殖。
小源总结:构建高质量CRISPR文库筛选的四大关键要素
| 步骤 | 核心任务 | 高分亮点 |
|---|---|---|
| 文库设计 | 自定义靶点,精准聚焦机制相关通路 | 小型定向文库,目标明确 |
| 筛选模型 | 搭建合适体外/体内系统 | 模拟真实病理状态,高信噪比 |
| 数据分析 | 富集分析+通路解析 | 多模型验证,交叉确认 |
| 靶点验证 | 表达水平+功能实验证实作用 | 形成机制闭环,支撑高分发表 |
未来趋势展望:CRISPR文库筛选的进阶应用场景
· 与单细胞组学结合:通过scRNA-seq辅助候选基因筛选,构建更精细化文库;
· 多模态筛选平台:将CRISPR筛选与药物刺激、高通量显微成像、AI分析结合;
· 疾病微环境模拟:更多体内CRISPR文库筛选(如肿瘤免疫微环境、小鼠人源化模型);
· 功能机制延伸:从靶点筛选进一步探究下游信号网络与调控轴,推动机制研究;
· CRISPRa/i 多通路联合筛选:筛选激活/抑制通路潜在组合靶点,用于联合用药开发;
关注我们,掌握前沿文库筛选策略,获取高分研究灵感!如果你希望我们帮你定制CRISPR文库方案,欢迎留言或联系专业技术顾问!
参考文献
[1] Hu, J., Sánchez-Rivera, F.J., Wang, Z. et al. STING inhibits the reactivation of dormant metastasis in lung adenocarcinoma. Nature 616, 806–813 (2023).
[2] Laughney, A.M., Hu, J., Campbell, N.R. et al. Regenerative lineages and immune-mediated pruning in lung cancer metastasis. Nat Med 26, 259–269 (2020).










