【前沿研究】新冠肺炎防治新思路!自噬抑制剂或是新冠肺炎潜在治疗药物


【前沿研究】新冠肺炎防治新思路!自噬抑制剂或是潜在治疗药物
2019新型冠状病毒 (SARS-CoV-2)导致的新型冠状肺炎迅速席卷全球并造成一场惊心动魄的疫情。有研究发现SARS-CoV-2增加了自噬体的数量,这似乎是一个很好的防治突破口。然而在一项针对非人类灵长类动物的研究表明,FAD批准的潜在候选药物氯喹(CQ)/氢氯喹作为一种自噬调节剂,并不能抑制SARS-CoV-2感染,并且最终发现它对COVID-19住院患者的死亡率没有任何有益影响。
针对这一情况,中国农业科学院长春兽医研究所Chao Shang等人认为关于SARS-CoV-2调节宿主内自噬体的机制需要在不同动物模型中进行充分的临床前研究,近期他们在Journal of Virology(2020 IF:5.1027)杂志上发表了名为“Inhibition of autophagy suppresses SARS-CoV-2 replication and ameliorates pneumonia in hACE2 transgenic mice and xenografted human lung tissues”的文章。文章中报告了在已建立的非人灵长类动物—食蟹猴(Macaca fascularis)模型、人血管紧张素转换酶2 (hACE2)转基因小鼠上进行SARS-CoV-2感染的结果,以及构建了基于人肺异种移植小鼠的原始SARS-CoV-2感染模型,最终揭示了SARS-CoV-2操纵自噬体形成的新机制,并提出自噬抑制剂可能是治疗SARS-CoV-2病毒感染的潜在药物,为SARS-CoV-2致病机制的研究及其防治提供新思路。

在食蟹猴感染模型发现SARS-CoV-2感染会触发自噬
研究人员通过收集sars - cov -2感染食蟹猴严重病变的肺组织和模拟感染的肺相应区域进行自噬分析,发现SARS-CoV-2感染后吞噬体或自噬体膜的重要组成部分Atg5-Atg12和LC3-I /LC3-I表达水平升高(提示自噬激活)。
在细胞水平发现SARS-CoV-2通过2种途径使自噬体增加
由于主要位于细胞质LC3-I在自噬激活后转化为LC3-II,LC3-II融入到延伸的吞噬细胞膜中,并控制其延伸成完全的自噬体,因此可将LC3-II作为可靠的自噬体标记物。通过WB实验发现,经SARS-CoV-2感染后,Vero E6和Huh-7细胞中LC3-II的表达水平呈现明显升高趋势。为直观观察自噬体的积累,研究人员构建GFP-LC3质粒瞬转的Vero E6及Huh-7细胞株(由源井生物提供),并发现经SARS-CoV-2感染24h(hpi)后细胞中GFP水平显著增强,这表明SARS-CoV-2感染诱导了自噬体的形成与积累。此外,进一步构建了EGFP-mCherry-LC3瞬转Vero E6细胞系(由源井生物提供)以可视化LC3从自噬体到溶酶体的转移,发现SARS-CoV-2是通过2种途径使得自噬体的数量增加:(1)自噬体的生物发生事件增加,(2)自噬体和溶酶体的融合减少。
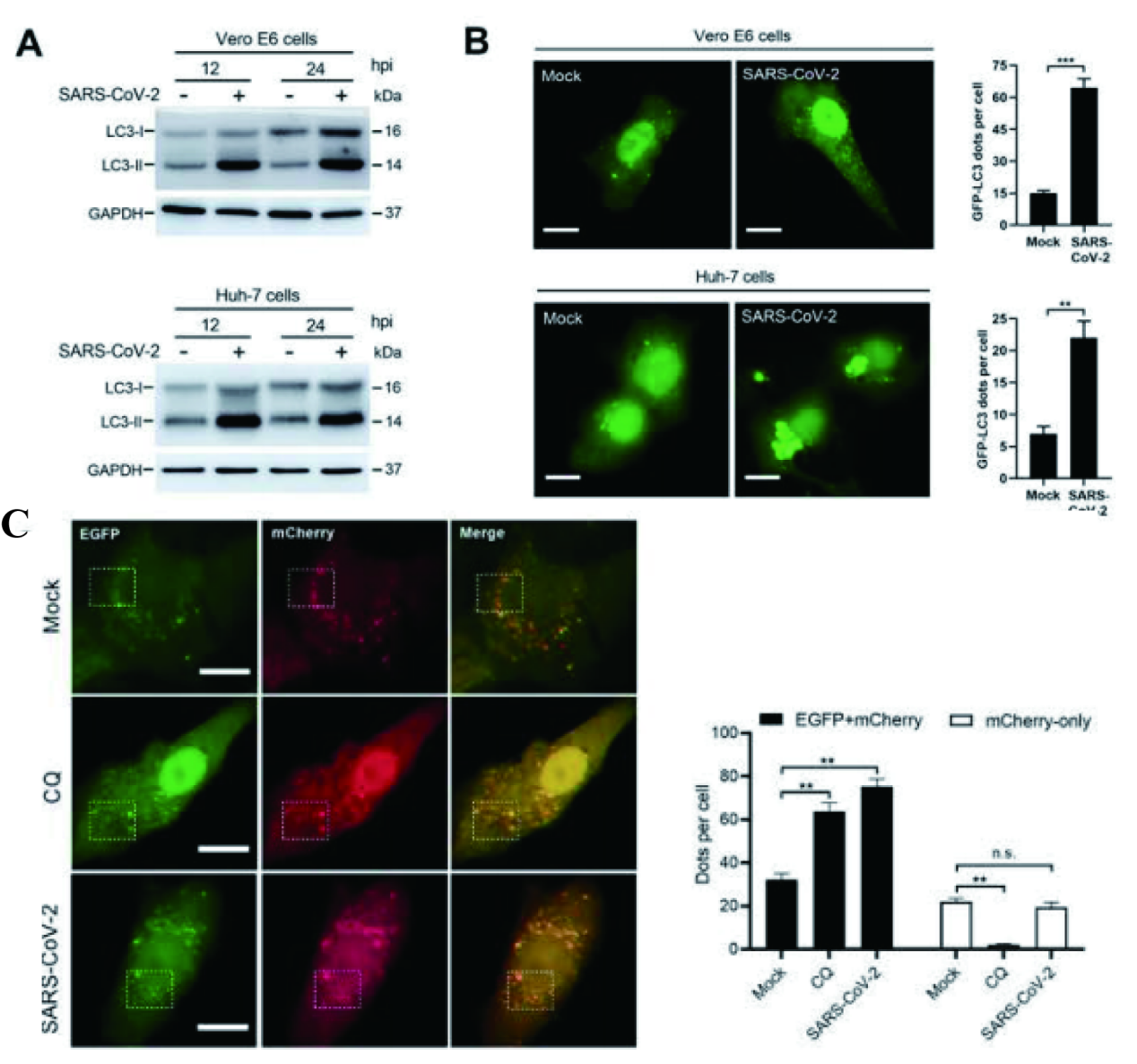
图1 SARS-CoV-2诱导细胞中自噬体的形成并阻断自噬体-溶酶体的融合
分析自噬相关的级联反应确定自噬体形成与病毒复制的关系
为了进一步阐明SARS-CoV-2诱导自噬小体形成的机制,研究人员在感染SARS-CoV-2的Vero E6细胞中对一系列参与自噬小体形成的信号级联进行分析,其中mTORC1信号通路作为最常见的上游自噬抑制调节因子,研究人员选择利用其下游底物的磷酸化来监测它的活性,最终发现SARS-CoV-2除了会抑制Akt-mTOR通路,还会激活ULK-1-Atg13和VPS34-VPS15-Beclin1复合物。接下来,为确定自噬体形成与病毒复制的关系及病毒复制的关键因子,研究人员使用广谱自噬抑制剂3-MA及VPS34抑制剂SAR405,发现3-MA及SAR405的预处理显著降低Vero E6细胞中的病毒载量,表明自噬形成及VPS34复合体的活化对SARS-CoV-2病毒复制的重要性。
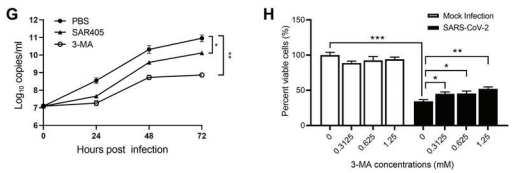
图2 自噬形成及VPS34复合体活化促进SARS-CoV-2病毒的复制
抑制自噬可抑制 SARS-CoV-2 复制并改善小鼠肺炎
最后,研究人员使用两种不同的动物模型模拟SARS-CoV-2在体内的感染过程。在hACE2 转基因小鼠模型中发现,抑制自噬可抑制 SARS-CoV-2病毒的复制并改善肺炎,相反的是,雷帕霉素(Rapamycin)诱导的自噬可促进病毒的自噬及加剧肺炎病变历程。
在他们创新性构建的新型小鼠模型(用人肺组织移植的)中证明SARS-CoV-2可在人肺组织中进行自我复制并自发产生肺炎。
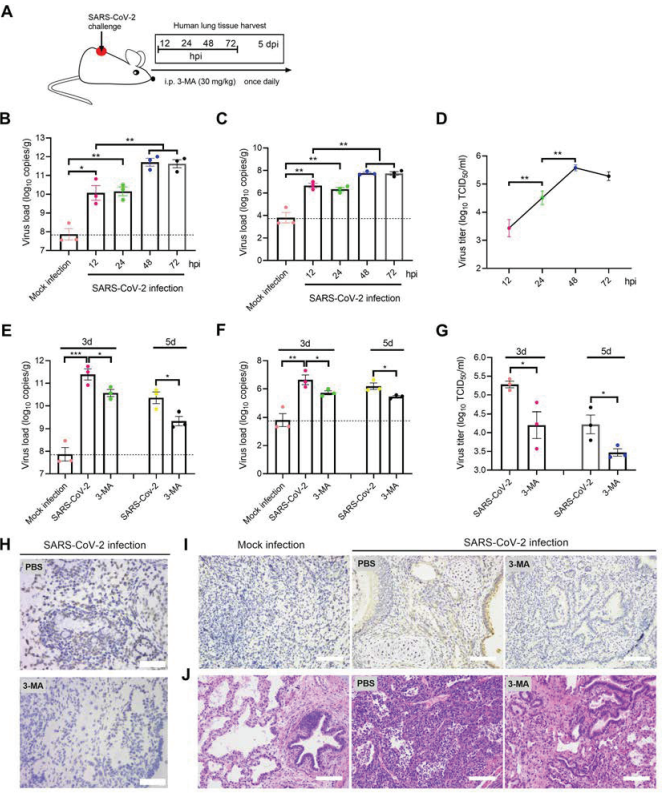
图3 抑制自噬可抑制 SARS-CoV-2 复制并改善异种移植人肺组织小鼠的肺炎
综上所述,研究人员证实了自噬促进SARS-CoV-2的复制并推动肺炎进程,并提出自噬抑制剂可能是治疗SARS-CoV-2病毒感染的潜在药物。这项研究通过体内外实验的相互验证为今后病毒-细胞交互的深层次研究奠定了理论基础,并为自噬相关的抗病毒药物的开发提供了有益思路。
源井生物一直专注于基因编辑细胞领域,在该研究中提供了基因编辑的Vero E6及Huh-7细胞株用于探究SARS-CoV-2病毒复制与自噬诱导机制间的关系。源井生物可提供优质的基因编辑细胞、稳转细胞株、病毒包装等相关服务,以及近2000种KO细胞现货库,基因敲除试剂盒等基因编辑相关产品,了解更多详情欢迎点击咨询!










