Nature Genetics(IF:29)| 首次发现:p53失活是乳腺癌脑转移的核心驱动因素


引言
腺癌脑转移预后极差,但其脑嗜性的分子机制一直不明。以色列特拉维夫大学Uri Ben-David和Ronit Satchi-Fainaro的研究团队发表在Nature Genetics的最新研究发现, p53失活是驱动乳腺癌脑转移的核心推手, 通过上调硬脂酰辅酶A去饱和酶1(SCD1)并增强脂肪酸代谢,为肿瘤细胞在脑微环境中存活增殖提供关键支持。研究团队结合临床数据分析、基因编辑细胞模型、动物实验及代谢组学技术,完整揭示了 “p53失活→SCD1/FAS激活→脂肪酸代谢重塑”的脑转移驱动通路, 同时证实脂肪酸合成抑制剂对p53缺陷型脑转移肿瘤具有显著疗效,为乳腺癌脑转移的精准治疗提供了全新靶点与策略。

研究背景
乳腺癌是女性最常见的恶性肿瘤,约13%的患者会发生脑转移,一旦出现脑转移,患者生存期显著缩短。p53(由TP53基因编码)是乳腺癌中最常发生异常的抑癌基因,其失活方式包括基因突变和17号染色体短臂(chr17p)缺失,但此前其在乳腺癌器官特异性转移(尤其是脑转移)中的作用尚未明确。脑微环境脂质资源匮乏,而脑转移肿瘤细胞常表现出脂肪酸合成(FAS)增强的代谢特征,星形胶质细胞作为脑微环境的关键成分,其与肿瘤细胞的相互作用及对脂肪酸代谢的调控机制也有待阐明。
研究目的
明确p53失活在乳腺癌脑转移中的作用及分子机制,揭示其与脂肪酸代谢的关联,并验证脂肪酸合成相关靶点的治疗潜力。
研究方法
- 临床数据分析: 整合TCGA、METABRIC等多个临床队列的基因组和转录组数据,分析p53失活与乳腺癌脑转移的相关性。
- 细胞模型构建: 利用CRISPR-Cas9技术构建p53野生型(WT)和失活型(敲除或突变)的同源乳腺癌细胞系(EMT6、CAL51),以及SCD1敲除细胞系。
- 动物实验: 通过心内注射建立脑转移模型,颅内注射评估肿瘤生长,结合MRI监测肿瘤体积变化;采用细胞竞争实验验证p53失活对脑转移的特异性促进作用。
- 代谢相关实验: 运用气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)分析脂肪酸组成及代谢物含量;通过同位素示踪(¹³C-棕榈酸、¹³C-谷氨酸)追踪代谢流向;利用条件培养基(ACM)模拟星形胶质细胞与肿瘤细胞的相互作用。
- 分子机制验证: 通过CUT&Tag、ChIP、Co-IP等技术解析p53对SCD1、DEPDC1、SREBP1的调控关系;采用RNA干扰(siRNA)敲低目标基因验证通路功能。
- 药物敏感性实验: 在细胞、类器官及动物模型中测试SCD1抑制剂(SW203668、A939572)、FASN抑制剂(C75)等的治疗效果。
研究路线
- 临床关联验证: 分析多队列临床数据,确认p53失活在乳腺癌脑转移中的高富集性,且其可作为脑转移风险的预测指标。
- 功能验证: 通过细胞和动物实验,证实p53失活特异性增强乳腺癌细胞的脑转移能力和脑内生长优势。
- 微环境互作分析: 明确星形胶质细胞通过分泌因子(如棕榈酸、谷氨酸)促进p53失活肿瘤细胞的增殖、迁移和存活。
- 代谢机制解析: 揭示p53失活通过上调CD36(脂肪酸摄取)和SCD1(脂肪酸合成),增强肿瘤细胞对脑微环境脂肪酸的利用和合成能力。
- 调控通路阐明: 证实p53直接结合SCD1启动子,同时通过抑制共激活因子DEPDC1间接调控SCD1表达,形成双重调控网络。
- 治疗潜力验证: 在细胞、类器官及动物模型中,验证脂肪酸合成抑制剂对p53缺陷型脑转移肿瘤的靶向治疗效果。
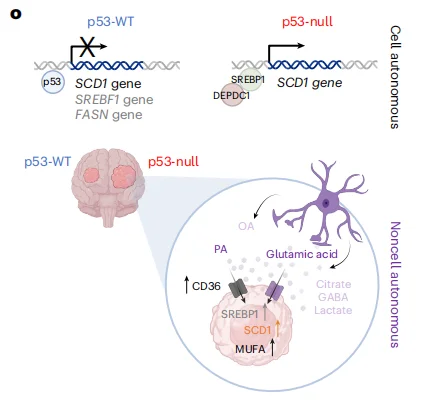
p53 失活通过脂肪酸代谢适应性改变驱动脑转移(BM)
主要结果
-
p53失活与乳腺癌脑转移高度相关: 临床数据显示,100%的乳腺癌脑转移灶存在p53失活(突变或chr17p缺失),其富集程度显著高于原发肿瘤和其他部位转移灶;p53失活的原发肿瘤更易发生脑转移,且该关联在多种癌种中保守。
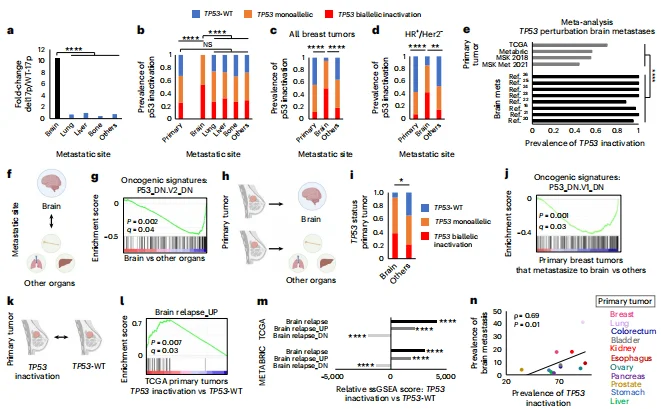
图1. 基因组与转录组分析临床数据表明,TP53基因扰动在 BCBM 中呈现高度富集
-
p53失活促进乳腺癌脑转移和脑内生长: 心内注射实验中,p53失活细胞的脑转移发生率(12/13只小鼠)显著高于野生型(2/11只小鼠);颅内注射后,p53失活细胞形成的肿瘤体积更大、增殖能力更强,且不受免疫状态影响。
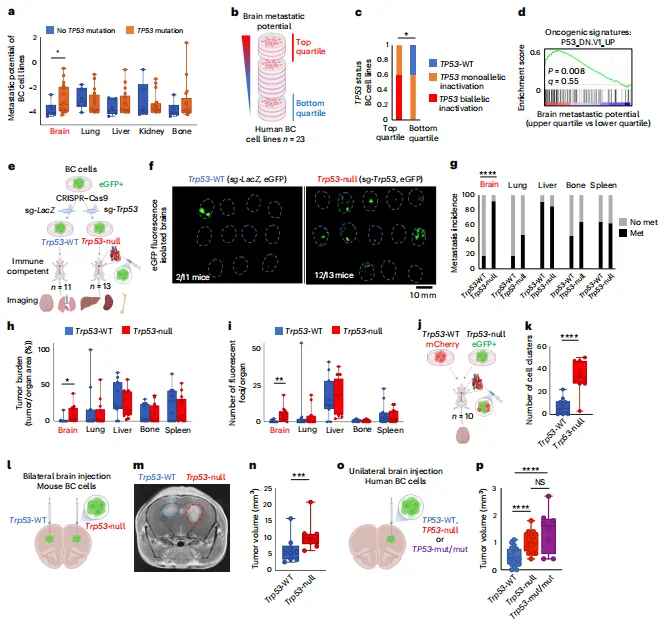
图2. TP53-WT乳腺癌细胞中p53失活可增加基底膜频率及生长
-
星形胶质细胞增强p53失活肿瘤的代谢适应: 星形胶质细胞分泌的棕榈酸(PA)和谷氨酸等代谢物,通过p53依赖的方式促进肿瘤细胞增殖和迁移;p53失活细胞通过上调CD36增强脂肪酸摄取,且对高浓度PA的耐受性更强。
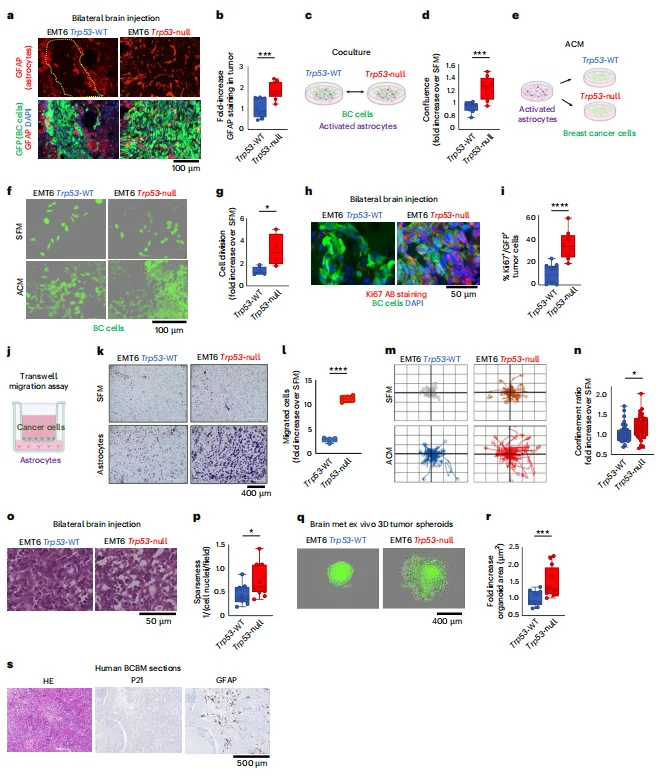
图3. 星形胶质细胞以p53依赖性方式刺激BC细胞的增殖、迁移和存活
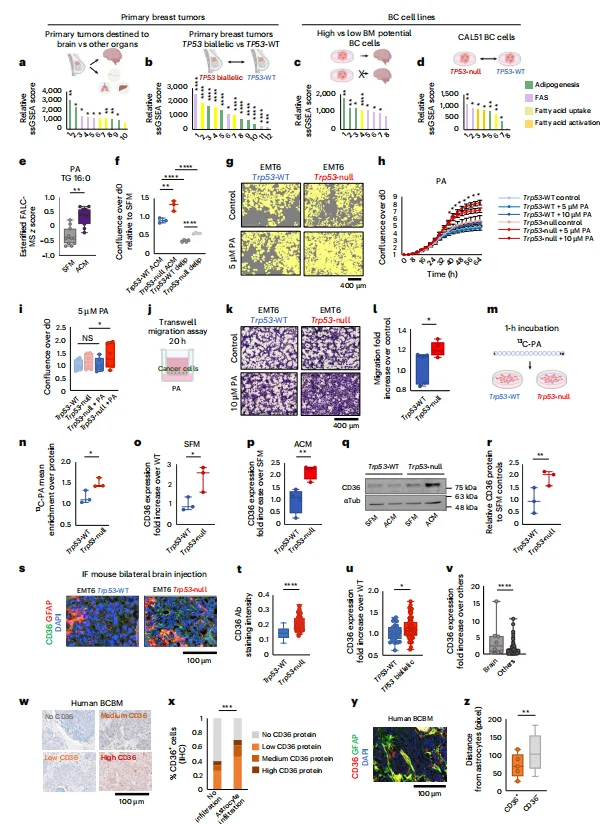
图4. CD36上调与脂肪酸摄取促进p53缺陷型乳腺癌细胞的增殖与迁移
-
p53失活驱动脂肪酸合成关键基因上调: p53失活显著增加SCD1、FASN等脂肪酸合成基因的表达,SCD1催化棕榈酸转化为单不饱和脂肪酸(MUFA),满足肿瘤快速增殖需求
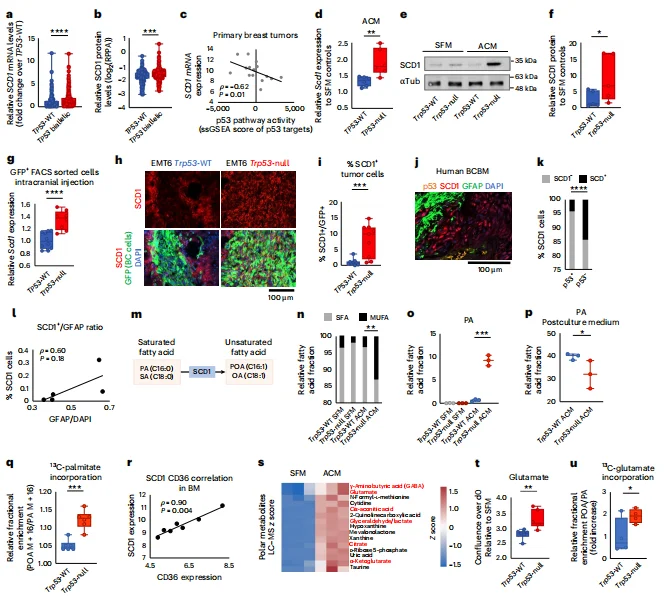
图5. SCD1上调与FAS促进p53缺陷型乳腺癌细胞的脑转移行为
CUT&Tag证实p53直接结合SCD1和SREBP1启动子,同时通过抑制DEPDC1(SREBP1的共激活因子)间接调控脂肪酸合成。
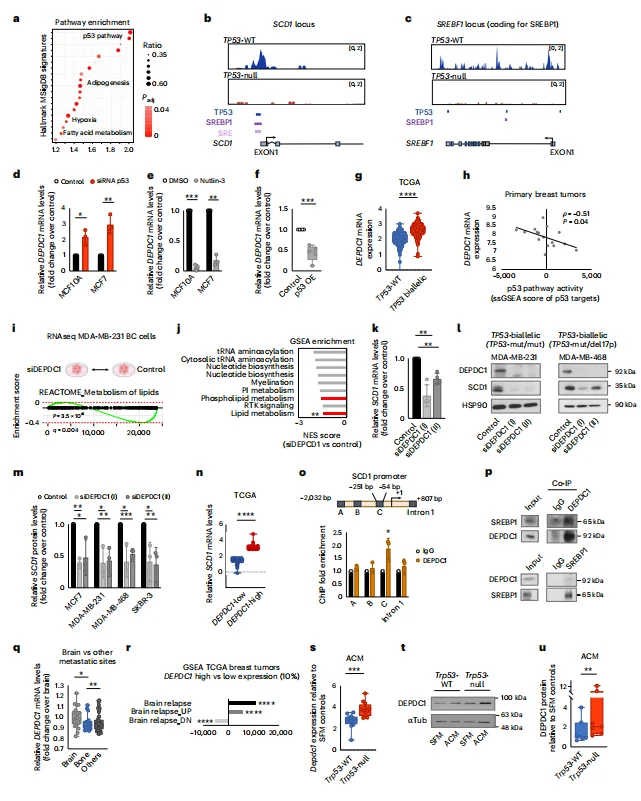
图6. p53在乳腺癌细胞中调控FAS的分子机制
-
SCD1是p53失活介导脑转移的关键介质: SCD1敲除可完全抵消p53失活带来的脑内生长优势,使肿瘤体积减少57%;补充SCD1产物(棕榈油酸、油酸)可模拟p53失活的促转移效应。
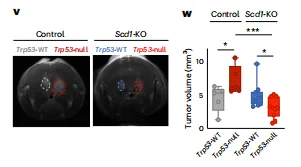
图7. SCD1是p53失活介导脑转移的关键介质。
-
脂肪酸合成抑制剂对p53缺陷型肿瘤有效: p53失活细胞对SCD1、FASN抑制剂的敏感性显著高于野生型细胞;在动物模型中,SCD1抑制剂可显著缩小p53失活型脑转移肿瘤体积,且患者来源的脑转移类器官对该抑制剂也表现出高敏感性。
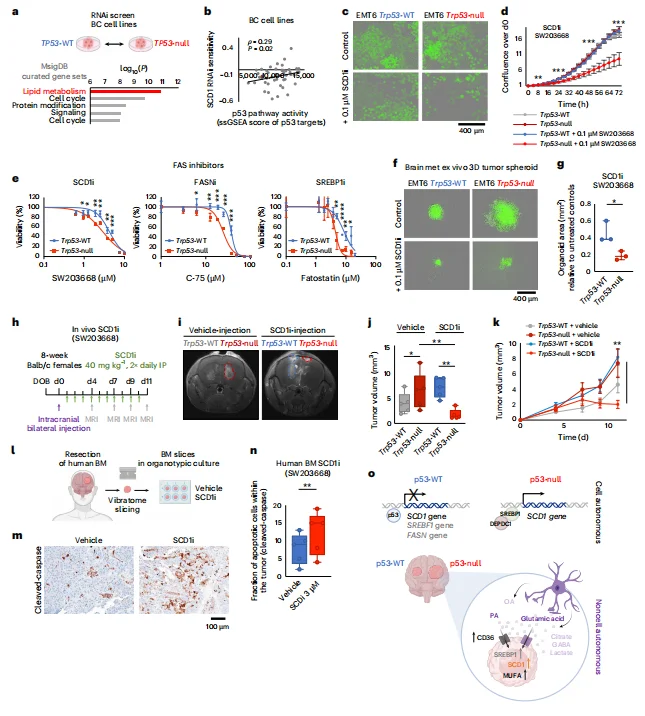
图8. 脂肪酸合成抑制剂对p53缺陷型肿瘤有效。
研究意义与创新点
- 理论创新: 首次明确p53失活是乳腺癌脑转移的核心驱动因素,揭示了“p53失活-星形胶质细胞互作-脂肪酸代谢重塑”的非细胞自主性调控网络,为理解肿瘤器官特异性转移的代谢适应机制提供了新范式。
- 机制突破: 阐明p53对脂肪酸合成的双重调控模式(直接结合靶基因启动子+间接调控共激活因子),明确SCD1是连接p53失活与脑转移的关键代谢节点。
- 临床价值: 建立p53失活作为乳腺癌脑转移风险的预测标志物,为患者分层提供依据;验证SCD1等脂肪酸合成靶点的治疗潜力,为p53缺陷型脑转移乳腺癌提供了全新的治疗方向,且已有抑制剂具备快速转化的临床前景。
文章小结
本研究通过临床数据分析、功能实验及机制解析,证实p53失活是乳腺癌脑转移的关键驱动因素,其通过直接和间接调控SCD1等脂肪酸合成相关基因,增强肿瘤细胞对脑微环境的代谢适应能力,星形胶质细胞分泌的代谢物进一步放大了这一效应。研究不仅揭示了乳腺癌脑转移的全新分子机制,还明确了脂肪酸合成抑制剂对p53缺陷型脑转移肿瘤的治疗潜力,为乳腺癌脑转移的风险预测和精准治疗提供了重要理论基础和转化靶点。
源井生物一直秉持 “让基因编辑更简单” 的核心理念,持续迭代产品与服务,已累计实现13000+基因编辑成功案例,拥有11000+细胞产品(含8000+KO细胞),自主研发的CRISPR创新技术,基因编辑效率相比于传统方法提升10-20倍。目前源井生物已为超10000个生命科学实验室、药企和CRO公司提供优质的基因编辑服务与产品。如果您有基因编辑的需要,欢迎咨询!
联系我们了解更多>>>参考文献
Laue K, Pozzi S, Zerbib J, Bertolio R, Eliezer Y, Cohen-Sharir Y, Winkler T, Caputo M, Ricci AA, Adler L, Khoury R, Longobardi G, Slutsky R, Leikin-Frenkel AI, Ovadia S, Lange K, Rustighi A, Piazza S, Sacconi A, Magesh RY, Keller FN, Berthelet J, Schäffer A, Saad R, Israeli Dangoor S, Szczepanowska K, Barshack I, Liao Y, Malitsky S, Brandis A, Broggini T, Czabanka M, Shi W, Merino D, Watson EV, Blandino G, Erez A, Ashery-Padan R, Medyouf H, Bertero L, Del Sal G, Satchi-Fainaro R, Ben-David U. p53 inactivation drives breast cancer metastasis to the brain through SCD1 upregulation and increased fatty acid metabolism. Nat Genet. 2025 Dec 29. doi: 10.1038/s41588-025-02446-1. Epub ahead of print. PMID: 41461910.










